Edelmetall-Katalysatoren: Der Leistungsverstärker - Die Unterstützung
Kapitel 1: Einleitung
Ein Edelmetallkatalysator ist ein Material, das die Geschwindigkeit einer chemischen Reaktion verändern kann, ohne selbst in den Endprodukten verbraucht zu werden. Zwar können fast alle Edelmetalle als Katalysatoren dienen, doch die am häufigsten verwendeten sind Platin, Palladium, Rhodium, Silber und Ruthenium, wobei Platin und Rhodium die breitesten Anwendungsmöglichkeiten haben. Ihre teilweise gefüllten d-Elektronen-Orbitale adsorbieren leicht Reaktanten an der Oberfläche mit mäßiger Bindungsstärke, was die Bildung zwischengeschalteter "aktiver Verbindungen" erleichtert und dadurch eine hohe katalytische Aktivität gewährleistet. In Verbindung mit überlegenen Eigenschaften wie Hochtemperatur-, Oxidations- und Korrosionsbeständigkeit gehören sie zu den wichtigsten katalytischen Materialien.
Edelmetallkatalysatoren sind aufgrund ihrer außergewöhnlichen katalytischen Aktivität und Selektivität in zahlreichen Schlüsselbereichen unverzichtbar. In der Umweltsanierung werden sie in großem Umfang in Abgasreinigungssystemen von Kraftfahrzeugen und bei industriellen Verbrennungsprozessen eingesetzt, um giftige Schadstoffe wie Kohlenmonoxid, Stickoxide und flüchtige organische Verbindungen effizient in unschädliche Gase umzuwandeln und so die Emissionen erheblich zu verringern. Sie spielen auch in anderen Bereichen des Umweltschutzes, wie der Luftreinigung und der Abwasserbehandlung, eine wichtige Rolle. In der industriellen Produktion sind sie von zentraler Bedeutung für die chemische Synthese, da sie die Reaktionsgeschwindigkeit und Produktselektivität durch katalysierte Reaktionen wie Hydrierung, Oxidation und Carbonylierung erhöhen. Darüber hinaus sind Edelmetallkatalysatoren im modernen Energiesektor der Eckpfeiler der Wasserstoffenergietechnologien, die für die Wasserstofferzeugung, den Betrieb von Brennstoffzellen und die Wasserstoffspeicherung unerlässlich sind und so die Umwandlung und Nutzung sauberer Energie vorantreiben.
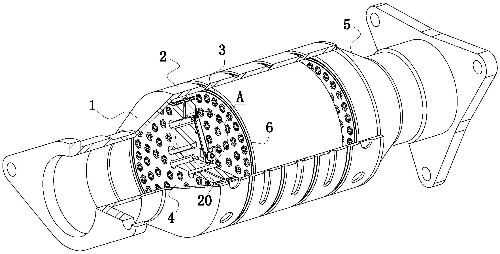
Abb. 1 Strukturelles Schema eines Drei-Wege-Katalysators für Kraftfahrzeuge
Die inhärenten Nachteile von Edelmetallen - ihre weltweite Knappheit, ihre hohen Kosten und ihre Anfälligkeit für Deaktivierung durch Versinterung, Auslaugung und Vergiftung - schränken ihre großtechnische Anwendung jedoch stark ein. Der Schlüssel zur Bewältigung dieser Herausforderungen liegt nicht in den Edelmetallen selbst, sondern in ihrem "Fundament" - dem Träger. Die moderne katalytische Wissenschaft zeigt, dass der Träger bei weitem nicht nur ein inertes physikalisches Gerüst ist, sondern eine multifunktionale Plattform und ein synergetischer Partner, der für die Überwindung der Grenzen der Edelmetalle entscheidend ist. Sein zentraler Wert manifestiert sich in zwei Schlüsselaspekten:
Der Träger mit seiner hohen spezifischen Oberfläche und seinen zahlreichen Oberflächendefekten bietet sichere "Verankerungsstellen" für Edelmetall-Nanopartikel oder sogar einzelne Atome, die eine Dispersion auf atomarer Ebene ermöglichen. Dadurch wird nicht nur die Freilegung der aktiven Stellen maximiert, was die Effizienz der Atomausnutzung erheblich verbessert, sondern auch die Migration und Agglomeration (Versinterung) der Teilchen bei hohen Temperaturen durch physikalische räumliche Beschränkungen und starke Wechselwirkungen wirksam verhindert, was die Stabilität des Katalysators grundlegend verbessert.
Zwischen dem Träger und dem Edelmetall bestehen tiefgreifende Wechselwirkungen. Durch elektronische Effekte (z. B. starke Metall-Träger-Wechselwirkungen, SMSI) kann der Träger die Elektronenwolkendichte des Edelmetalls modulieren und seine Adsorptionskraft für die Reaktanten optimieren, wodurch die intrinsische katalytische Aktivität und Selektivität verbessert wird. Darüber hinaus können die inhärente Säure/Basizität der Oberfläche oder die Redox-Eigenschaften des Trägers synergetisch Reaktionen mit den aktiven Stellen des Edelmetalls katalysieren, wodurch komplexe Reaktionswege ermöglicht werden, die mit Einzelkomponenten nicht erreicht werden können, wodurch insgesamt effiziente bifunktionale katalytische Systeme entstehen.
Kapitel 2: Kernfunktionen und Mechanismen des Trägers
Bei der Entwicklung von Edelmetallkatalysatoren ist der Träger nicht nur ein passives Reaktionsgefäß, sondern eine Schlüsselkomponente, die mehrere aktive Rollen spielt. Seine funktionellen Mechanismen beeinflussen die endgültige Leistung des Katalysators in hohem Maße, was sich vor allem in vier Bereichen zeigt:
1. Dispersion und Stabilisierung
Die Hauptfunktion des Trägers besteht darin, als "Verankerung" für Edelmetall-Nanopartikel zu dienen. Eine hohe spezifische Oberfläche (z. B. Hunderte von m2/g) bietet zahlreiche Ladestellen, so dass das Edelmetall im Nanomaßstab oder sogar auf atomarer Ebene stark dispergiert werden kann, wodurch die Freilegung der aktiven Stellen maximiert und die Effizienz der Atomnutzung verbessert wird. Ohne Träger wandern, agglomerieren und sintern Edelmetall-Nanopartikel aufgrund ihrer hohen Oberflächenenergie bei höheren Temperaturen leicht, was zu einer drastischen Verringerung der aktiven Oberfläche und zur Deaktivierung führt. Darüber hinaus können die Porenstrukturen vieler Trägermaterialien einen Begrenzungseffekt bewirken, der die Metallpartikel in den Nanohohlräumen oder Zwischenschichten einschließt, so dass "Nanoreaktoren" entstehen, was ihre Bewegung und ihr Wachstum physisch behindert und die thermische Stabilität weiter erhöht.

Abb. 2 Poröse Materialien
2. Elektronische Effekte
Zwischen dem Träger und dem Edelmetall bestehen tiefgreifende elektronische Wechselwirkungen, vor allem die starke Metall-Träger-Wechselwirkung (SMSI). Am Beispiel des Pt/TiO2-Systems zeigt sich, dass nach einer Hochtemperatur-Reduktionsbehandlung ein Teil des Ti4+ auf der TiO2-Oberfläche reduziert wird und auf die Oberfläche der Pt-Nanopartikel wandert und eine Suboxidschicht bildet. Dieser Prozess geht mit einer Elektronenübertragung von TiO2 auf Pt einher, wodurch sich die Elektronenwolkendichte von Pt ändert und folglich seine Adsorptionsstärke und -weise für Reaktionsmoleküle (z. B. CO, O2) moduliert wird. Diese "Fernsteuerung" durch elektronische Effekte kann die katalytische Aktivität und Selektivität für bestimmte Reaktionen erheblich verbessern und sogar eine Resistenz gegen Vergiftungen verleihen.
3. Synergistische Katalyse
Viele Träger sind nicht inert; ihre Oberflächen besitzen saure/basische Stellen oder inhärente katalytisch aktive Stellen, die eine synergistische Katalyse mit dem Edelmetall ermöglichen und einen "bifunktionalen" Mechanismus darstellen. Bei der katalytischen Reformierung in der Erdölraffination beispielsweise ist Pt im Pt/γ-Al2O3-Katalysator für die Hydrierung/Dehydrierung von Olefinen verantwortlich, während die sauren Stellen auf der γ-Al2O3-Oberfläche die Isomerisierung von Carbokationen erleichtern; beide Funktionen wirken zusammen, um Kohlenwasserstoffmoleküle zu rekonstruieren. Ein weiteres Beispiel ist die Anodenreaktion in Brennstoffzellen, wo RuOH-Spezies in PtRu/C-Katalysatoren die Wasseraktivierung fördern und benachbarte Pt-Stellen mit OH-Spezies versorgen, um CO zu oxidieren, wodurch das Problem der Vergiftung von Pt-Katalysatoren durch CO gelöst wird.
Abb. 3 Kooperative Katalyse von organischen kleinen Molekülen und Metallen
4. Massen- und Wärmeübertragung
Die physikalische Struktur des Trägers bestimmt die Transporteffizienz von Reaktanten und Produkten. Eine genaue Abstimmung der Porenstruktur (einschließlich Porengröße, Porenvolumen und Konnektivität) optimiert die Diffusionsraten und vermeidet Verluste der Reaktionseffizienz aufgrund von Einschränkungen des Stofftransfers. Makroporen begünstigen einen schnellen Stofftransport, Mesoporen eignen sich zur Beladung mit Nanopartikeln und zur Erleichterung von Reaktionen, und Mikroporen können eine Formselektivität ermöglichen. Gleichzeitig verfügen hervorragende Träger über eine hohe thermische Stabilität und Wärmeleitfähigkeit, so dass sie exothermen Hochtemperaturreaktionen standhalten, die Reaktionswärme schnell abführen und den Zusammenbruch der Katalysatorstruktur und die Versinterung der aktiven Komponente durch lokale Überhitzung verhindern können.
Kapitel 3: Haupttypen von Trägern für Edelmetallkatalysatoren und ihre Eigenschaften
1. Oxidträger
Oxidträger sind die am umfassendsten untersuchte und am häufigsten verwendete Kategorie.
γ-Al2O3: Bekannt als "Arbeitspferdeträger", zu dessen Vorteilen eine große spezifische Oberfläche, ein geeigneter Säuregehalt der Oberfläche und eine gute mechanische Festigkeit gehören. Aufgrund dieser Eigenschaften ist er ideal für Drei-Wege-Katalysatoren für die Automobilindustrie (Beladung mit Pt, Pd, Rh) und Katalysatoren für die Hydrodesulfurierung (Beladung mit Pd).
SiO2: Besitzt in der Regel eine neutrale Oberfläche und eine hohe spezifische Oberfläche. Seine Oberflächeninertheit bedeutet, dass es die intrinsische Aktivität des Edelmetalls nicht beeinträchtigt. Abstimmbares mesoporöses SiO2 kann durch Schablonenverfahren hergestellt werden und findet breite Anwendung in selektiven Hydrierungs- und Oxidationsreaktionen.
TiO2: Neben seiner hohen spezifischen Oberfläche ist sein wichtigstes Merkmal die Fähigkeit, starke Metall-Träger-Wechselwirkungen (SMSI) mit Edelmetallen zu bilden, was die katalytische Leistung deutlich verbessert. Gleichzeitig ist TiO2 ein ausgezeichneter lichtempfindlicher Halbleiter, der in Kombination mit Au, Pt usw. ein großes Potenzial für die Photokatalyse zur Wasserspaltung und zum Abbau von Schadstoffen aufweist.
CeO2: Es besitzt eine einzigartige Sauerstoffspeicherkapazität (OSC), die es ihm ermöglicht, über den Ce4+/Ce3+-Zyklus schnell zwischen oxidierenden und reduzierenden Atmosphären zu wechseln und so die Sauerstoffkonzentration in der Reaktionsumgebung wirksam zu regulieren. Diese Eigenschaft macht es unentbehrlich für die Reinigung von Autoabgasen (als Co-Katalysator) und für Redoxreaktionen.
Tabelle 1: Vergleich der wichtigsten Eigenschaften von Oxidträgern
|
Trägertyp |
Spezifischer Oberflächenbereich |
Oberflächeneigenschaft |
Wichtigste Merkmale |
Typische Anwendungen |
|
γ-Al2O3 |
Hoch |
Schwach säurehaltig |
Hohe mechanische Festigkeit, gute thermische Stabilität |
Autoabgasreinigung, Hydrotreating |
|
SiO2 |
Hoch |
Neutral |
Abstimmbare Porengröße, inerte Oberfläche |
Selektive Hydrierung, Oxidation |
|
TiO2 |
Mittel |
Amphoterisch |
SMSI, Photokatalytische Aktivität |
Photokatalyse, CO-Oxidation |
|
CeO2 |
Mittel |
Grundlegend |
Ausgezeichnete Sauerstoffspeicherkapazität |
Drei-Wege-Katalysatoren, Wasser-Gas-Verschiebungsreaktion |
2. Kohlenstoff-Materialträger
Kohlenstoffmaterialien zeichnen sich durch ihre Leitfähigkeit und strukturelle Vielfalt aus.
Aktivierter Kohlenstoff: Zeichnet sich durch eine extrem hohe spezifische Oberfläche und zahlreiche funktionelle Oberflächengruppen (z. B. -OH, -COOH) aus, wodurch er sich leicht modifizieren und mit Metallen beladen lässt. Aufgrund seiner geringen Kosten wird er häufig für Flüssigphasenreaktionen (z. B. feinchemische Hydrierung) und die Elektrokatalyse verwendet.
Kohlenstoff-Nanoröhren/Graphen: Diese neuartigen Kohlenstoffmaterialien verfügen über eine einzigartige sp²-hybridisierte Kohlenstoffstruktur, eine extrem hohe Leitfähigkeit und regelmäßige Porenkanäle. Sie induzieren nicht nur elektronische Effekte mit Edelmetallen durch π-π-Konjugation, sondern sorgen aufgrund ihrer außergewöhnlichen Leitfähigkeit auch für einen schnellen Elektronentransfer während der Elektrokatalyse und zeigen damit eine hervorragende Leistung in Bereichen wie Brennstoffzellen (z. B. Pt/CNTs für die Sauerstoffreduktion) und Wasserelektrolyse.
3. Zeolith-Träger
Zeolithe sind kristalline Alumosilikate, die sich vor allem durch ihre geordneten mikroporösen Kanalsysteme und ihren einstellbaren Säuregehalt auszeichnen.
Selektivität der Form: Ihre Porengrößen auf molekularer Ebene (typischerweise <2 nm) ermöglichen einen selektiven Durchgang von Reaktanten und Produkten je nach Größe und Form und damit eine formselektive Katalyse. So können beispielsweise bei der Pt/Zeolith-katalysierten Dieselhydrofinierung geradkettige Alkene selektiv hydriert werden, während verzweigte Alkane zurückgehalten werden.
Starke Acidität und Einschließungseffekt: Ihre starken Säurezentren in Verbindung mit dem Einschluss der Metallpartikel in den Mikroporen sorgen dafür, dass sie sich bei Reaktionen wie der Isomerisierung und Aromatisierung von Alkanen auszeichnen.
4. Andere neuartige Trägermaterialien
Mit den Fortschritten in der Nanotechnologie zeigt eine Reihe von neuartigen Trägern großes Potenzial.
Metallorganische Gerüste (MOFs): Sie bestehen aus Metallionen und organischen Bindemitteln und zeichnen sich durch eine extrem hohe spezifische Oberfläche und eine atomar gestaltbare Porenumgebung aus, was sie zu idealen Plattformen für die einatomige Dispersion von Edelmetallen und die größenselektive Katalyse macht.
Mesoporöse Materialien: SBA-15 und MCM-41 weisen hochgradig geordnete mesoporöse Strukturen und enge Porengrößenverteilungen auf, die ideale Kanäle für den Stofftransport und die Reaktion großer Moleküle bieten und die Probleme des langsamen Stofftransfers mikroporöser Materialien lösen.
Karbide/Nitride: Wie Molybdänkarbid und Kohlenstoffnitrid weisen sie eine metallähnliche Leitfähigkeit, hohe chemische Stabilität und thermische Stabilität auf. Als neue Elektrokatalysatorträger oder synergistische Katalysatoren haben sie das Potenzial, herkömmliche Träger zu ersetzen.
Tabelle 2: Vergleich der Eigenschaften anderer Trägertypen
|
Trägertyp |
Strukturelles Merkmal |
Hauptvorteil |
Potenzielle Anwendungen |
|
Zeolithe |
kristallin mikroporös |
Formselektivität, starke Acidität |
Formselektive Hydrierung, Isomerisierung, Molekularsiebung |
|
MOFs |
kristallin porös |
Ultrahohe Oberfläche, gestaltbare Struktur |
Einzel-Atom-Katalyse, Gasspeicherung/Trennung |
|
Mesoporöse Materialien |
Geordnete Mesoporen |
Gleichmäßige Porengröße, hohe Stofftransporteffizienz |
Katalyse großer Moleküle, Biosensorik |
|
Karbide/Nitride |
Interstitielle Verbindungen |
Hohe Leitfähigkeit, hohe Stabilität |
Elektrokatalyse, korrosionsbeständige Katalyse |
Kapitel 5: Herausforderungen und Zukunftsperspektiven
Edelmetallkatalysatoren sind zwar unverzichtbar, stehen aber vor erheblichen Hürden, die die laufende Forschung vorantreiben. Die größte Herausforderung sind nach wie vor die hohen Kosten und die natürliche Knappheit dieser Metalle, die bei großtechnischen Anwendungen wie der Fahrzeugkatalyse und der Massenproduktion von Chemikalien zu wirtschaftlichen Problemen und Problemen in der Lieferkette führen. Hinzu kommt ihre inhärente Tendenz zur Deaktivierung, vor allem durch Sinterung - bei der sich die Nanopartikel bei höheren Temperaturen zu größeren, weniger aktiven Partikeln zusammenballen - und durch Vergiftung durch Reaktionsnebenprodukte. Darüber hinaus wird die Leistung dieser Katalysatoren häufig durch herkömmliche Trägermaterialien eingeschränkt, die lediglich als passives Gerüst fungieren und das Edelmetall nicht aktiv verstärken oder stabilisieren können. Eine tiefer gehende wissenschaftliche Herausforderung besteht darin, dass die dynamischen Veränderungen an den aktiven Stellen unter realen Betriebsbedingungen und die genauen Struktur-Aktivitäts-Beziehungen nur unzureichend verstanden werden, was ein rationales Design erschwert.
Künftige Fortschritte sind eng mit innovativen Strategien zur Maximierung von Effizienz und Haltbarkeit verbunden. Ein zentraler Schwerpunkt ist die Maximierung der Effizienz der Atomenutzung. Dabei geht es nicht nur um die einfache Dispersion von Nanopartikeln, sondern auch um fortschrittliche Architekturen wie Einzelatomkatalysatoren (SAC), die theoretisch eine 100 %ige Metalldispersion erreichen können, sowie um ausgeklügelte Kern-Schale- oder Nano-Rahmen-Strukturen, die wertvolle Atome an der Oberfläche konzentrieren, wo Reaktionen stattfinden. Die "Atom-Extraktions"-Strategie beispielsweise zeigt, wie das Design von Legierungen genutzt werden kann, um Edelmetallatome aus dem Kern eines Nanopartikels an seine Oberfläche zu ziehen, wodurch die Effizienz drastisch gesteigert und gleichzeitig die Belastung minimiert wird.
Gleichzeitig wird die Rolle des Trägers von einem passiven Beobachter zu einem aktiven, synergetischen Partner umdefiniert. Die Zukunft liegt in der intelligenten Konstruktion von Trägern, die eine präzise elektronische und geometrische Steuerung ermöglichen. Dazu gehören die Entwicklung starker Metall-Träger-Wechselwirkungen (SMSI) zur Optimierung der elektronischen Eigenschaften und die Verwendung neuartiger Materialien wie metallorganische Gerüste (MOFs) oder 2D-Doppelhydroxidschichten (LDHs), die atomar definierte Umgebungen zur Stabilisierung von Metallatomen bieten. Das Konzept des Confinement-Effekts, bei dem Metallpartikel physikalisch in porösen Strukturen gefangen sind, ist ein wirksamer Ansatz zur Verhinderung von Sinterung.
Das Entwicklungsparadigma verschiebt sich von der empirischen Entdeckung zum rationalen Design. Die Integration von maschinellem Lernen, Hochdurchsatzberechnungen und fortschrittlicher In-situ-Charakterisierung beschleunigt die Entdeckung neuer Materialien und unser Verständnis der katalytischen Mechanismen. Neben der Optimierung des Einsatzes von Edelmetallen ist das langfristige Streben nach Katalysatoren mit niedrigem Platingruppenmetallgehalt (PGM) und schließlich nach PGM-freien Katalysatoren, die auf erdreichreichen Übergangsmetallen basieren, weiterhin ein entscheidender, wenn auch schwieriger Weg zu einer nachhaltigen Katalyse. Diese kombinierten Bemühungen zielen darauf ab, die traditionellen Kompromisse zwischen Aktivität, Stabilität und Kosten zu überwinden.

Abb. 4 Nanotechnologie der Zukunft
Kapitel 6: Schlussfolgerung
Zusammenfassend lässt sich sagen, dass der Träger in Edelmetallkatalysatoren mehrere Rollen spielt, die weit über das bloße physikalische Gerüst hinausgehen. Er ist der Eckpfeiler für das Erreichen einer hohen Dispersion, einer hohen Stabilität und einer hohen Ausnutzungseffizienz von Edelmetallen und ist der Schlüssel zur aktiven Verbesserung der katalytischen Leistung durch elektronische und synergistische Effekte. Angesichts der zentralen Herausforderungen der Edelmetallknappheit und -instabilität ist die künftige Richtung klar: ein Wechsel vom traditionellen empirischen Screening zum präzisen rationalen Design. Durch die Konstruktion von Ein-Atom-Katalysatoren, Kern-Schale-Strukturen und die Entwicklung neuartiger multifunktionaler Träger können wir Edelmetalle auf atomarer und nanoskaliger Ebene "exquisit dekorieren". Dies wird uns letztendlich in die Lage versetzen, den Einsatz von Edelmetallen drastisch zu reduzieren und gleichzeitig die katalytische Leistung und Lebensdauer um ein Vielfaches zu erhöhen, was die treibende Kraft für eine nachhaltige Entwicklung in der Energie-, Umwelt- und Chemieindustrie darstellt.
Wenden Sie sich an Stanford Advanced Materials (SAM), wenn Sie fortschrittliche Edelmetallkatalysatorlösungen benötigen, die diesen neuen Anforderungen gerecht werden.
Weiterführende Lektüre:
Verständnis der Katalysatorvergiftung bei Edelmetallkatalysatoren: Ursachen, Probleme und Lösungen
Katalyse neu definiert: Vorteile von Palladium auf Kohlenstoff
Referenzen:
[1] Bell, A. T. (2003). Die Auswirkungen der Nanowissenschaft auf die heterogene Katalyse. Wissenschaft, 299(5613), 1688-1691.
[2] Somorjai, G. A., & Li, Y. (2010). Einführung in die Oberflächenchemie und Katalyse. Wiley.
[3] Tauster, S. J., Fung, S. C., & Garten, R. L. (1978). Starke Metall-Träger-Wechselwirkungen. Group 8 Noble Metals Supported on TiO2. Journal of the American Chemical Society, *100*(1), 170-175.
[4] Cargnello, M., et al. (2013). Control of Metal Nanocrystal Size Reveals Metal-Support Interface Role for Ceria Catalysts. Science, 341(6147), 771-773.

 Bars
Bars
 Perlen & Kugeln
Perlen & Kugeln
 Bolzen & Muttern
Bolzen & Muttern
 Tiegel
Tiegel
 Scheiben
Scheiben
 Fasern & Stoffe
Fasern & Stoffe
 Filme
Filme
 Flocke
Flocke
 Schaumstoffe
Schaumstoffe
 Folie
Folie
 Granulat
Granulat
 Honigwaben
Honigwaben
 Tinte
Tinte
 Laminat
Laminat
 Klumpen
Klumpen
 Maschen
Maschen
 Metallisierte Folie
Metallisierte Folie
 Platte
Platte
 Pulver
Pulver
 Stab
Stab
 Blätter
Blätter
 Einkristalle
Einkristalle
 Sputtering Target
Sputtering Target
 Rohre
Rohre
 Waschmaschine
Waschmaschine
 Drähte
Drähte
 Umrechner & Rechner
Umrechner & Rechner
 Schreiben Sie für uns
Schreiben Sie für uns
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


