Die Verwendungszwecke von Vanadium und seine Verwendungszwecke nach seinen Oxidationsstufen
Dieser Inhalt stammt aus einem Beitrag zum Stanford Advanced Materials College Scholarship 2025 von Addison Boyle.
Einführung
Vanadium gehört zu den Übergangsmetallen; seine Ordnungszahl ist 23. Sein Vorkommen in der Erdkruste ist mit 0,02 % ähnlich hoch wie das von Zink.1 Trotz seines Vorkommens fand es erst in den letzten 50 Jahren große Beachtung. Forschungen zeigten, dass Vanadium durch das Vanadat-Ion einen biologischen Nutzen haben könnte.2 Es gibt mindestens 6 verschiedene Oxidationsstufen; Vanadium kommt hauptsächlich in den Stufen +3, +4 und +5 vor. Isoliert zeigt jede Oxidationsstufe eine andere Farbe. V4+ ist blau, V3+ ist grün und V2+ ist violett.3 Diese Oxidationsstufen sind auch für biologische Systeme am wichtigsten.4
Vanadium im Blut:
Diese Oxidationsstufen von Vanadium sind wichtig, weil sie Redoxreaktionen durchlaufen können.4 Die Stabilität hängt von der Bindung, dem Lösungsmittel und dem pH-Wert ab.2 Biogen bedeutet dies, dass es Reduktionsmittel gibt, die Vanadium in niedrigere Oxidationsstufen umwandeln können.4 Dieser Prozess ist pH-abhängig; wenn der pH-Wert erhöht wird, verringern sich die Redoxpotentiale.4 Wenn es in Form von Arzneimitteln eingenommen wird, gelangt es in den Blutkreislauf und geht in die Bestandteile des Blutserums über.4 Die Reaktion mit dem Vanadium bestimmt die Vanadiumspeziation.1
Unter leicht sauren Bedingungen ähnelt V(III), wenn es gebildet wird, bestehenden biologischen Systemen.1 Im Blutplasma könnten Reduktionsmittel vorhanden sein, die zu einer Stabilisierung von V(III) führen, so dass V(III)2-hTF-Spezies gebildet werden können.1 DieseSpezies ähneln Fe(III) 2-hTF, das von den Zellrezeptoren erkannt wird.1 Dies kann geschehen, wenn V(III) oder Fe(III) von hTF angezogen werden, wenn V(IV)O im Blutplasma verfügbar ist, dann könnte eine Reduktion zu V(III) vom Energiegewinn her günstig sein.1 Die Bindung von V(III) hat einen logK 20, während V(IV)O+2 einen logK 13 hat.1 Diese Reaktion muss unter mild sauren Bedingungen stattfinden.1
Es hat sich gezeigt, dass andere Oxidationsstufen von Vanadium (V(IV) und V(V)) einen Ligandenaustausch und eine Redoxumwandlung erfahren können.1 Liganden mit niedriger Molekülmasse sind Laktat und Citrat, Liganden mit hoher Molekülmasse sind hTF, Albumin und Immunglobulin G.1 hTF ist der vorherrschende Ligand.1 Wie bei V(III) reagieren auch V(IV) und V(V) aufgrund der Reste der Fe(III)-Bindungsstellen von hTF gut.1 Da Fe(III) 2-hFT von den Zellrezeptoren für die Endozytose erkannt wird.1 Dies könnte auch für V(IV)- und V(V)-Komplexe möglich sein.1 Bei der Inkubation von V(IV)OSO4 und apo-hTF wird gezeigt, dass sie hTF entsprechen.1 Es wird auch gezeigt, dass das Verhältnis der Bildung niedriger ist als das von Fe(III) 2hTF.1Es hat sich gezeigt, dass VIVO und VIVO-Trägerkomplexe zusammen mit V(V) als Monovanadat an holo-hTF binden könnten, das das Transportmittel im Blut ist.1 Das bedeutet, dass Vanadium im Blutplasma vorhanden sein und durch Endozytose gehen könnte, wenn holo in die Zellen gelangt.1
Vanadat:
In der wässrigen Chemie gibt es 3 Haupttypen von Reaktionen, die mit Vanadat durchgeführt werden können: Selbstkondensationsreaktionen, Koordinationsreaktionen und Redoxreaktionen.4
Bei Kondensationsreaktionen werden Vanadat-Anionen durch Oligomere in einem leicht sauren Milieu protoniert, um es günstiger zu machen.4 Dies ist für die Zellfunktion von entscheidender Bedeutung, da der pH-Wert die verschiedenen Organellen beeinflusst.4 Bei Tumorzellen hat sich gezeigt, dass sie einen erhöhten Organellen-pH-Wert haben.4 Dies könnte bedeuten, dass Vanadat verwendet werden könnte, um die Tumorzellen mit dem erhöhten pH-Wert zu finden.4 Dies könnte mit einer Reihe von Oligomeren von Vanadat in einem sauren Milieu geschehen.4
Da Vanadat Ähnlichkeiten mit Phosphat aufweist, hat man begonnen, Vanadat in Koordinationsreaktionen zu verwenden, aber es befindet sich noch größtenteils im Reagenzglasstadium, was bedeutet, dass die meisten koordinierten Reaktionen theoretisch sind.4 Phosphat ist wichtig für biologische Systeme und ist an vielen biologischen Erkennungs- und Biokatalysatorsystemen beteiligt.1 VO43- hat strukturelle und elektronische Ähnlichkeit mit PO43- Abb. 1.4 Vanadatkomplexe haben eine trigonal-bipyramidale 5-Koordinaten-Geometrie, die den 5-Koordinaten-Übergangszuständen entspricht, von denen man annimmt, dass sie bei der Reaktion von phosphatabhängigen Enzymen gebildet werden Abb. 1.1 Während es ein- und mehrzähnige Liganden geben kann, werden in erster Linie Vanadatester und Vanadatanhydride verwendet, weil sie dem Phosphat entsprechen. 4 Bei der Computermodellierung lag der größte Teil des Vanadats in Form von H2VO4- und HVO42- vor, wenn Proteine ausgeschlossen wurden; wenn Proteine einbezogen wurden, war der größte Teil des Vanadins an Transferrin gebunden.4 Wenn der Metallkomplex von Vanadat durch Liganden stabilisiert wird, erhöht dies die Wahrscheinlichkeit der Reduktion.4 Dies führt zu Koordinationsreaktionen, die in biologischen Systemen zur Reduktion neigen.4
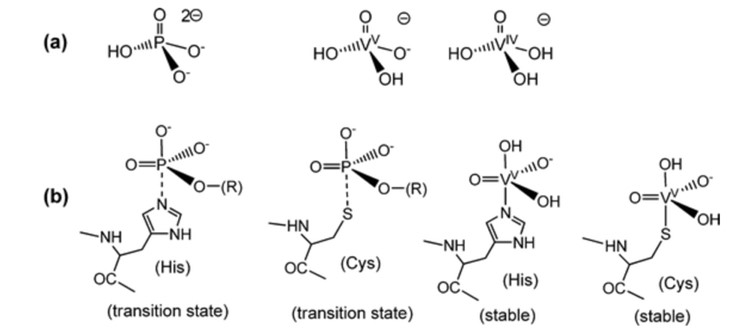
Abb. 1. Vergleich von Phosphaten und Vanadat mit Übergangszuständen und Stabilität.5
Bei Redoxreaktionen in biologischen Systemen sind die Oxidationsstufen, auf die es bei Vanadium ankommt, +3, +4 und +5.4 Der größte Teil der Reduktion von Vanadat erfolgt von V(V) zu V(IV).4 Diese Art von Reaktion findet bei einer Vielzahl von Biomolekülen statt, insbesondere in Organellen.4 Es wird auch als Puffer für Phosphotyrosylproteine verwendet.4 Dies führt zum Eingriff in den Insulin-Signalweg.4 Dies kann bei der Behandlung von Diabetes eingesetzt werden, da Vanadat, sobald es an die aktive Stelle des Enzyms gebunden ist, nicht so leicht freigesetzt werden kann wie das Phosphat.1 Dadurch wird die Stelle von Phosphat abgeschottet, was zu einer Hemmung des Enzyms führt.1 Es gibt Nachteile bei der Verwendung von Vanadat zur Behandlung von Diabetes, wie z. B. Vanadium-induzierter oxidativer Stress, globale Toxizitätsprobleme, die Auswirkungen auf das Immunsystem und Entzündungen.1
Krebsforschung:
Die Eigenschaften von Vanadium wurden im Hinblick auf ihre chemopräventive und antitumorale Wirkung bei der Krebsbekämpfung untersucht.1 Die Tests scheinen sich hauptsächlich auf Tierversuche und bösartige Zelllinien zu beziehen.1 Vanadocendichlorid und verschiedene Peroxovanadate sind die wichtigsten Vanadiumverbindungen, die verwendet wurden.1 Vanadocendichlorid ist wasserlöslich, und bei einem pH-Wert von 7 werden die Chloridionen durchH2Oersetzt, was zu V(C5H5)2]2+ führt.1 Es hat sich gezeigt, dass es an die DNA bindet, was zu einem anderen Verhalten als Cisplatin führt.1 Es hat auch eine begrenzte Toxizität gezeigt, keine Übertragung über die Blutschranke, und wird im Gehirn nicht nachgewiesen.1 Die Ziele für die krebsbekämpfenden Eigenschaften von Vanadium sind die Störung des Zellstoffwechsels, der Signaltransduktionswege und der Zellproliferation.1 Es gab Bedenken hinsichtlich der verschiedenen Reaktionen und der Sicherheit von Vanadium, was zu einem Mangel an klinischer Forschung führte.1 Angesichts dieser Bedenken wird weiterhin geforscht.1 V(V)-mhcpe-Systeme wurden in vitro getestet und zeigten, dass sie für Tumorzellen toxischer sind als für Nicht-Tumorzellen.1 V(IV)-Komplexe mit 1-10-Phenanthrolin-Derivaten als Liganden und V(IV)O-dppz-Komplexe haben krebshemmende Eigenschaften gezeigt (Abb. 2), insbesondere gegen Leukämie.1
Abb. 2. Darstellung der Antitumorwirkung von Vanadatverbindungen, mit Pufferstabilität pH 7,1
Amavadin:
Es gibt einen Pilz, der Vanadium akkumuliert, Amanita muscaria oder Fliegenpilz genannt.6 Ein typischer Pilz enthält weniger als 0,5 mg V kg-1, aber A. muscaria kann 100 mg V kg-1 enthalten.6 Die Teile des Pilzkörpers, die Vanadium enthalten, sind Stiel, Huthaut, Hutfleisch, Kiemen, Sporen und Knolle.6 Die höchste Vanadiumkonzentration findet sich in der Knolle mit 1000 mg V kg-1.6 Dieser Teil des Pilzes befindet sich an der untersten Stelle des Stiels und ist daher am anfälligsten für Verunreinigungen aus dem Boden.6 Bei der Untersuchung des Oberbodens lag der Medianwert von Vanadium bei 60 mg kg-1, mit einer Spanne von 1,28 und 537 mg kg-1.6 Das in A. muscaria gefundene Vanadium war negativ geladen und wurde von Bayer und Kneifel als Amavadin bezeichnet (Abb. 3).6 Durch Elektronen-Paramagnetische-Resonanz-Spektroskopie (EPR) wurde entdeckt, dass die Oxidationsstufe des Vanadiums +4 war.6 EPR-Spektren zeigten auch, dass die verschiedenen Teile des Pilzes dieselbe Verbindung Amavadin enthielten.6 Es handelt sich um zwei tetradentate Liganden, wie in Abb. 3 gezeigt, die sich an das Vanadiumzentrum koordinieren können, wodurch zwei Isomere entstehen, die in synthetischem und natürlichem Amavadin in fast gleicher Mischung auftreten.6
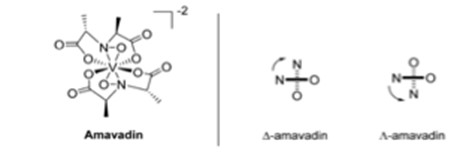
Abb. 3. Struktur von Amavadin, mit den Isomeren D und L.6
Die Oxidation von V(IV) zu V(V) ist in Amavadin reversibel, was bedeutet, dass es katalytische Eigenschaften haben könnte.6 Es wurde festgestellt, dass der Komplex ein breites Spektrum von Reaktionen katalysiert.6 Dies führte dazu, dass verschiedene Amavadin-Analoga mit unterschiedlichen Metallionenzentren oder modifizierten Liganden synthetisiert wurden.6 Bei der Synthese von Amavadin aus A. muscaria wurde festgestellt, dass es verschiedene Vanadiumkomplexe gibt, von denen der bekannteste Vanadylacetat ist.6 Der Feststoff besteht zu 26 % (w/w) aus Vanadylacetat und zu 74 % (w/w) aus Amavadin.6
Schlussfolgerung
Zusammenfassend lässt sich sagen, dass Vanadium in biologischen Systemen auf vielfältige Weise verwendet wird. Das Spektrum reicht von der Krebsbehandlung bis hin zu Pilzen. Die Forschung hat sich mit den verschiedenen Oxidationsstufen befasst und damit, wie sie in biologischen Systemen, wie z. B. im Blut oder in Zellen, reduziert werden können. Die primären Oxidationsstufen von Vanadium sind +3, +4 und +5. Die Liganden, die gewöhnlich mit Vanadium in Verbindung gebracht wurden, waren Sauerstoffkomplexe, insbesondere Vanadat und Vanadylacetat. Die Forschung über Vanadium und seine Auswirkungen auf die Wissenschaft muss noch weiter vorangetrieben werden.
Referenzen:
1. J. Costa Pessoa, Journal of Inorganic Biochemistry, 2015, 147, 4-24
2 A. Butler, und C. J. Carrano, Coordination Chemistry Reviews, 1991, 109, 61-65
3 D. Rehder, Bioinorganic Vanadium Chemistry, Wiley, Incorporated, New York, 2008.
4 X. Yang und K. Wang, in Progress in Molecular and Subcellular Biology, eds. W. E. G. Muller, P. Jeanteur, R. E. Rhoads, D. Ugarkovic, and M. R. Custodio. Springer, Manz, Deutschland, 2013, Kap. 1, S. 1-19.
5. d. Rehder, Metallomics, 2015, 7, 732
6 S. Braeuer, M. Walenta, L. Steiner, und W. Goessler, Royal Society of Chemistry, 2021, 36, 954-967.

 Bars
Bars
 Perlen & Kugeln
Perlen & Kugeln
 Bolzen & Muttern
Bolzen & Muttern
 Tiegel
Tiegel
 Scheiben
Scheiben
 Fasern & Stoffe
Fasern & Stoffe
 Filme
Filme
 Flocke
Flocke
 Schaumstoffe
Schaumstoffe
 Folie
Folie
 Granulat
Granulat
 Honigwaben
Honigwaben
 Tinte
Tinte
 Laminat
Laminat
 Klumpen
Klumpen
 Maschen
Maschen
 Metallisierte Folie
Metallisierte Folie
 Platte
Platte
 Pulver
Pulver
 Stab
Stab
 Blätter
Blätter
 Einkristalle
Einkristalle
 Sputtering Target
Sputtering Target
 Rohre
Rohre
 Waschmaschine
Waschmaschine
 Drähte
Drähte
 Umrechner & Rechner
Umrechner & Rechner
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


