Bessere Pt-, Pd- und Au-Edelmetallkatalysatoren: Die Lösung von Leistungsengpässen
Zusammenfassung
Edelmetallkatalysatoren sind aufgrund ihrer herausragenden intrinsischen Aktivität von zentraler Bedeutung für die Steigerung der Effizienz von Energie- und Chemieprozessen. Ihr praktischer Einsatz wird jedoch durch anhaltende Probleme in Bezug auf Aktivität, Selektivität, Stabilität und Kosten eingeschränkt. Diese Übersicht befasst sich systematisch mit den wichtigsten Leistungseinschränkungen von drei bekannten Edelmetallkatalysatoren - Pt, Pd und Au - und untersucht fortschrittliche Materialdesignstrategien, die zur Überwindung dieser Probleme entwickelt wurden. Wir konzentrieren uns insbesondere auf:
1) Legierung und Kern-Schale-Architekturen in Pt-basierten Katalysatoren zur Verbesserung der Sauerstoffreduktionsaktivität und Haltbarkeit in Brennstoffzellen;
2) Einzelatom- und Nanocluster-Konfigurationen in Systemen auf Pd-Basis zur Erzielung einer besseren Selektivität und Sinterungsbeständigkeit bei Kreuzkupplungsreaktionen; und
3) Trägerdesign und Größenkontrolle bei Au-Katalysatoren, um eine hohe Aktivität bei der CO-Oxidation bei niedrigen Temperaturen zu erreichen.
Durch den Vergleich der maßgeschneiderten Lösungen für diese drei katalytischen Systeme soll diese Arbeit interdisziplinäre Erkenntnisse liefern und das rationale Design der nächsten Generation von leistungsstarken, langlebigen und kostengünstigen Edelmetallkatalysatoren anleiten.

Abb. 1 Nano-Edelmetallkatalysatoren
1 Einleitung
Edelmetallkatalysatoren (wie Platin, Palladium, Rhodium usw.) dienen als kritische Materialien in der modernen Industrie- und Energiewirtschaft und spielen eine zentrale Rolle in der Raffination, der chemischen Synthese, der Emissionskontrolle bei Kraftfahrzeugen und in der Wasserstoffwirtschaft. Insbesondere vor dem Hintergrund der weltweiten Umstellung auf sauberere Energiestrukturen treibt die rasche Entwicklung der Brennstoffzellen- und kohlenstoffarmen Wasserstoffindustrie die Nachfrage nach Platingruppenmetallen weiter in die Höhe. Branchenprognosen zufolge wird die weltweite Produktionskapazität für sauberen Wasserstoff bis 2030 voraussichtlich zehn Millionen Tonnen überschreiten, was die strategische Bedeutung von Edelmetallkatalysatoren in der Energieversorgungskette weiter festigt.
Die breite Einführung von Edelmetallkatalysatoren steht jedoch noch vor zahlreichen strukturellen Herausforderungen. Die weltweite Jahresproduktion von Platingruppenmetallen ist begrenzt und geografisch konzentriert, was die Lieferketten sehr anfällig für geopolitische Spannungen und Marktschwankungen macht. Um die Abhängigkeit von externen Ressourcen zu verringern, ist die Verbesserung der Recyclingeffizienz wichtiger Materialien für viele Länder zu einer vorrangigen Strategie geworden. Gegenwärtig stützt sich die Rückgewinnung von Edelmetallen aus verbrauchten Industriekatalysatoren hauptsächlich auf Verfahren wie Pyrolyse, hydrometallurgische Extraktion und pyrometallurgisches Schmelzen. Diese Verfahren sind jedoch im Allgemeinen durch einen hohen Energieverbrauch und durch Verunreinigungen beeinträchtigte Rückgewinnungsraten gekennzeichnet. Im Rahmen der technologischen Innovation entwickeln die Forscher Alternativen für Nichtedelmetalle und umweltfreundliche Lösungsmittelsysteme, um die Abhängigkeit von neuen Mineralien zu verringern. Gleichzeitig treiben immer strengere Umweltvorschriften die Einführung von Managementsystemen voran, die den gesamten Lebenszyklus von Katalysatoren abdecken - von der Herstellung über die Verwendung bis hin zur Regeneration - und die Industrie dazu veranlassen, ein Gleichgewicht zwischen Ressourceneffizienz und Umweltverantwortung zu finden.
Präzises Strukturdesign hat sich als Schlüsselparadigma zur Überwindung von Leistungsengpässen bei Edelmetallkatalysatoren erwiesen. Diese Strategie zielt darauf ab, eine synergetische Kontrolle über die elektronischen und geometrischen Strukturen aktiver Stellen auf atomarer Ebene zu erreichen. Konkret wird durch Techniken zur Modulation der elektronischen Struktur, wie z. B. Legieren und Strain Engineering, das Adsorptionsverhalten von Reaktionszwischenprodukten optimiert, wodurch die intrinsische Aktivität erhöht wird. Geometrisches Engineering - wie z. B. die Konstruktion von einzelnen Atomen, Nanoclustern, spezifischen Kristallebenen oder Kern-Schale-Strukturen - maximiert die Dichte und Stabilität der aktiven Stelle. Gleichzeitig ermöglichen die Konstruktion von Ladungsträgerschnittstellen und räumliche Begrenzungseffekte eine präzise Lenkung der Reaktionswege, wodurch Herausforderungen bei der selektiven Kontrolle und Langzeitstabilität überwunden werden. In diesem Beitrag werden auf der Grundlage dieses Konzepts systematisch strukturelle Designstrategien für drei repräsentative Katalysatoren - Pt, Pd und Au - untersucht.

Abb. 2 Edelmetallkatalysatoren für die Gasverbrennung
2 Allgemeine Probleme und Mechanismen des Leistungsabfalls bei Edelmetallkatalysatoren
2.1 Mangel an aktiver Stelle und niedrige Ausnutzungsrate
2.1.1 Adsorption von Giftstoffen und Blockierung der aktiven Stellen
Verunreinigungen im Reaktionsfeed, wie schwefelhaltige (z. B. H₂S, schwefelorganische Verbindungen) und chlorhaltige Spezies (z. B. Chloridionen, Organochlorine), können stark an die aktiven Zentren von Edelmetall-Nanopartikeln adsorbieren. Dieser Chemisorptionsprozess führt häufig zur Bildung von stabilen Oberflächenverbindungen wie Rhodiumsulfid (Rh₂S₃) oder Rhodiumchlorid (RhCl₃), die die katalytischen Stellen dauerhaft besetzen und deaktivieren. Darüber hinaus kann die Ablagerung dieser Verunreinigungen auf dem Katalysatorträger die Mesoporen und Mikroporen von Kohlenstoffmaterialien physikalisch blockieren und dadurch die Diffusion von Reaktionsmolekülen zu den aktiven Stellen behindern.
2.1.2 Agglomeration von Metallpartikeln und Abbau des Trägers
Edelmetall-Nanopartikel (typischerweise 2-10 nm groß) sind anfällig für Migration und Koaleszenz während Hochtemperatur-Reaktionszyklen, was zur Bildung großer Agglomerate von über 50 nm führt. Dieses Sinterungsphänomen kann die elektrochemisch aktive Oberfläche um über 75 % verringern. Gleichzeitig unterliegt der Kohlenstoffträger selbst bei längerer Einwirkung hoher Temperaturen einer Degradation, die sich in Form von thermischer Zersetzung, Rissbildung und Verlust der mechanischen Festigkeit äußert. Dieser strukturelle Zusammenbruch des Trägers beschleunigt die Agglomeration der Metallpartikel weiter und beeinträchtigt die Gesamtintegrität der Katalysatorarchitektur.
2.1.3 Durch Prozessschwankungen verursachte Auflösung und Ablösung
Betriebsinstabilitäten, insbesondere wenn das Redoxpotential des Reaktionssystems über das Toleranzfenster des Katalysators (typischerweise ±0,3 V) hinaus schwankt, können in saurem Milieu eine anodische Auflösung des Edelmetalls bewirken. Bei diesem Prozess entstehen lösliche ionische Spezies wie Rh³⁺, die zu einem irreversiblen Metallverlust führen. Parallel dazu kann eine längere Einwirkung von stark sauren oder alkalischen Bedingungen eine Hydrolyse oder Neutralisierung der funktionellen Gruppen auf der Oberfläche des Kohlenstoffträgers bewirken, wodurch die Wechselwirkung zwischen Metall und Träger geschwächt wird und sich die aktiven Partikel ablösen.
2.1.4 Dampfvermittelte Korrosion und Porenkollaps
In Systemen, die Wasserdampf enthalten, erzeugen die Kondensation und Permeation von Dampf in den Nanoporen des Kohlenstoffträgers Kapillarkräfte und Grenzflächenspannungen. Diese Spannungen können zu Mikrobrüchen und zum Zusammenbruch der Porenstruktur führen. Gleichzeitig kann Wasserdampf mit Verunreinigungen (z. B. Cl-, SO₄²-) in Wechselwirkung treten und einen lokal begrenzten korrosiven Elektrolyten bilden, der die Auflösung von Metallnanopartikeln und ihre anschließende Ablösung von dem beeinträchtigten Träger beschleunigt.
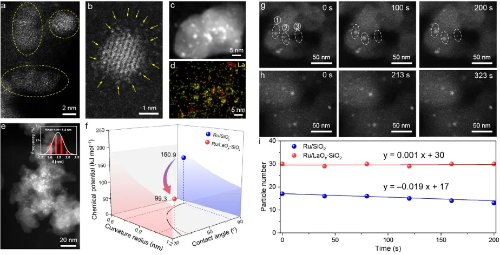
Abb. 3 Nanostrukturierte Inselkatalysatoren, die dem Sintern von Partikeln entgegenwirken
2.2 Sinterung und Ostwald-Reifung von Nanopartikeln
Die Sinterung von Metallnanopartikeln auf dem Träger ist eine wesentliche Ursache für die Hochtemperaturdeaktivierung in heterogenen Katalysatoren. Nach herkömmlicher Auffassung erfolgt die Sinterung hauptsächlich durch zwei substratvermittelte Mechanismen: Ostwald-Reifung sowie Partikelwanderung und Koaleszenz. Während fortschrittliche In-situ-Techniken, wie z. B. die Transmissionselektronenmikroskopie, diese Mechanismen unter Umgebungsdruckbedingungen bestätigt haben, sind die dynamischen Entwicklungsmechanismen von Nanopartikeln unter den extremen industriellen Bedingungen von hohen Temperaturen und hohem Druck nach wie vor unzureichend bekannt.
Jüngste Forschungsarbeiten, bei denen reaktive kinetische Monte-Carlo-Simulationen in Verbindung mit Dichtefunktionaltheorieberechnungen zum Einsatz kamen, haben einen bisher unerkannten Mechanismus des Partikelhüpfens und der Koaleszenz (PHC) unter hohem CO-Druck und erhöhter Temperatur aufgedeckt. Bei diesem Prozess lösen sich Au-Nanopartikel vom Anatas-TiO₂(101)-Träger ab, machen über die Gasphase einen "Luftsprung" und verschmelzen mit anderen Partikeln. Sobald die zusammengewachsenen Cluster eine kritische Größe überschreiten, lagern sie sich wieder auf der Trägeroberfläche ab. Dieses Verhalten wird durch die starke Wechselwirkung zwischen CO-Molekülen und Au-Atomen an der Grenzfläche bei hohem chemischem CO-Potenzial angetrieben, das die Bindungsenergie zwischen Nanopartikeln und Träger übersteigt.
Dieser Mechanismus erklärt nicht nur die schnellen Deaktivierungswege von Katalysatoren unter realistischen Arbeitsbedingungen, sondern deutet auch darauf hin, dass die Versinterung von Nanopartikeln und die Migration zwischen den Trägern weitaus häufiger und dynamischer auftreten können als bisher angenommen. Die Ergebnisse bieten eine neue theoretische Perspektive für das Verständnis des Verlusts an thermischer Stabilität in industriellen Katalysatoren und schaffen einen methodischen Rahmen für die Simulation von Systemen im Nanomaßstab über gekoppelte räumliche und zeitliche Skalen.

Abb. 4 Ostwald-Reifung
2.3 Vergiftung von Edelmetallkatalysatoren
Unter Vergiftung von Edelmetallkatalysatoren versteht man das Phänomen, dass Spurenverunreinigungen im Reaktionssystem die aktiven Stellen durch Chemisorption oder chemische Reaktionen irreversibel besetzen oder abbauen, was zu einem erheblichen Rückgang der Aktivität und Selektivität des Katalysators führt. Dies ist eine der Hauptursachen für die Deaktivierung industrieller Katalysatoren.
2.3.1 Vergiftungsmechanismen und -arten
Auf der Grundlage der Art der Wechselwirkung zwischen dem Gift und den aktiven Stellen werden Vergiftungen in der Regel in zwei Typen eingeteilt:
A) Chemische Vergiftungen: Das Gift interagiert stark mit den aktiven Stellen durch chemische Kräfte. Dies ist die häufigste Form der Vergiftung.
- Vergiftungen durch starke Chemisorption: Giftmoleküle unterliegen einer irreversiblen oder stark reversiblen Chemisorption an den aktiven Stellen, wobei die Adsorptionsenergien viel höher sind als die der Zielreaktanten, wodurch die Stellen physisch blockiert werden. So weisen beispielsweise schwefel-, phosphor- und cyanidhaltige Verbindungen eine sehr starke Adsorptionsfähigkeit an vielen Metalloberflächen auf.
- Vergiftung durch elektronische Effekte: Das Gift verändert die elektronische Struktur (z. B. das d-Band-Zentrum) der aktiven Zentren der Edelmetalle, indem es Elektronen abgibt oder entzieht, wodurch sich die Adsorptionskapazität für die Reaktanten verändert und die katalytische Reaktion verhindert wird.
- Vergiftung durch strukturelle Effekte: Bestimmte Gifte können eine Umlagerung von Oberflächenatomen bewirken, wodurch die ursprüngliche geometrische Struktur der aktiven Zentren gestört wird.
B) Physikalische Vergiftung/Verschmutzung: Das Gift selbst geht möglicherweise keine starke chemische Wechselwirkung mit den aktiven Zentren ein, sondern lagert sich physikalisch über den aktiven Zentren oder an den Porenöffnungen des Trägers ab und behindert den Stofftransport der Reaktanten.
2.3.2 Gängige Gifte und ihre Mechanismen
Die verschiedenen Edelmetalle sind unterschiedlich empfindlich gegenüber verschiedenen Giften. In der folgenden Tabelle sind typische Gifte und ihre Wirkungen aufgeführt:
Tabelle 1 Typische Gifte
|
Gift-Kategorie |
Repräsentative Substanzen |
In erster Linie betroffene Katalysatoren |
Kurzbeschreibung des Mechanismus |
|
Schwefelhaltige Verbindungen |
H₂S, COS, SO₂, Mercaptane, Thiophen |
Pt, Pd, Rh, Ru |
S-Atome besitzen einsame Elektronenpaare, die eine hochwirksame Koordination mit den d-Orbitalen der Edelmetalle ermöglichen und stabile M-S-Bindungen bilden. Sie gehören zu den häufigsten und stärksten Giften. |
|
Halogenhaltige Verbindungen |
Cl-, HCl, Organochloride |
Pt, Pd |
Halogenionen oder -atome sind sehr elektronegativ und adsorbieren stark an Metalloberflächen, wodurch sie die katalytische Leistung durch elektronische Effekte verändern. Manchmal können sie durch die Bildung flüchtiger Halogenide zu Metallverlusten führen. |
|
Schwermetall-Verbindungen |
Verbindungen von Pb, Hg, As, Bi, Sn |
Die meisten Edelmetallkatalysatoren |
Diese Metalle oder ihre Ionen haben ein geringes Ablagerungspotenzial auf Edelmetalloberflächen und können aktive Stellen durch irreversible Metallverschiebung oder Legierungsreaktionen dauerhaft bedecken. |
|
Phosphor-/Stickstoffhaltige Verbindungen |
PH₃, Phosphine, Amine, Cyanide |
Ni, Pd, Pt |
Ähnlich wie bei S-haltigen Verbindungen haben P- und N-Atome eine starke Koordinationsfähigkeit und können stabile Koordinationsbindungen mit aktiven Zentren bilden. |
|
Ungesättigte Kohlenwasserstoffe / Koks |
Alkene, Alkine, Koksvorläufer |
Die meisten Metallkatalysatoren |
Polymerisations- und Dehydrierungsreaktionen bei hohen Temperaturen, wobei sich hochmolekulare kohlenstoffhaltige Ablagerungen bilden, die die aktiven Zentren und Poren physisch bedecken. |
2.3.3 Faktoren, die das Ausmaß der Vergiftung beeinflussen
Art des Giftes: Die Stärke der Adsorption, sterische Hinderung und elektronische Effekte des Giftmoleküls mit der aktiven Stelle.
Eigenschaften des Katalysators: Die elektronische Struktur der verschiedenen Edelmetalle bestimmt ihre Widerstandsfähigkeit gegenüber Vergiftungen; so ist Pt empfindlich gegenüber CO, während Pd empfindlich gegenüber S ist. Die Eigenschaften des Trägers beeinflussen ebenfalls die Diffusion und Adsorption von Giften.
Prozessbedingungen: Temperatur, Druck, Reaktantenkonzentration usw. Beispielsweise kann eine hohe Temperatur bestimmte Gifte desorbieren, aber auch die Verkokung beschleunigen; eine reduzierende Atmosphäre kann die Adsorption bestimmter oxidierender Gifte (z. B. SO₂) hemmen.
2.4 Metallauflösung und -auslaugung
Die Auflösung und Auslaugung von Metallen ist ein kritischer Degradationspfad in der Elektrokatalyse, der insbesondere Katalysatoren auf Platin- und Palladiumbasis unter Betriebsbedingungen betrifft. Der elektrochemische Auflösungsmechanismus umfasst komplexe potenzialabhängige Prozesse, bei denen Edelmetallatome zu löslichen ionischen Spezies oxidiert werden. Platin beispielsweise wird sequentiell oxidiert, um Pt²⁺- und Pt⁴⁺-Ionen zu bilden, die in den Elektrolyten wandern und einem dynamischen Auflösungs- und Ablagerungsprozess folgen, bei dem sich gelöste Spezies bevorzugt an größeren Partikeln oder kathodischeren Bereichen ablagern. Dieses Phänomen wird unter den Bedingungen des Potenzialwechsels erheblich beschleunigt, wobei die Auflösungsraten stark von Betriebsparametern wie Potenzialfenster, Temperatur, pH-Wert und Abtastraten beeinflusst werden.
Strukturelle Defekte dienen als primäre Initiierungsstellen für die Auflösung, wobei Ecken, Kanten und Versetzungsstellen eine höhere Anfälligkeit für oxidativen Angriff aufweisen. Fortgeschrittene In-situ-Studien zeigen, dass Kern-Schale-Nanostrukturen, wie Pd@Pt-Nanowürfel, durch galvanische Korrosion und halogenidinduzierte Korrosionsmechanismen, die an der Kern-Schale-Grenzfläche beginnen und sich nach außen ausbreiten, eine verstärkte Degradation erfahren. Gleichzeitig verschlimmert die Korrosion des Trägermaterials, insbesondere die Zersetzung des Kohlenstoffträgers bei hohen Potentialen und Temperaturen, den Metallverlust weiter, indem sie die Verankerung der Partikel schwächt.
Vermeidungsstrategien konzentrieren sich auf die Verbesserung der thermodynamischen Stabilität der Metallatome durch Modulation der elektronischen Struktur. Die Legierung von Platin mit edleren Elementen wie Gold zeigt eine bemerkenswerte Wirksamkeit, wobei die Einbindung von Au das Auflösungspotential erhöht und die Auflösungsrate durch Elektronenspende, die den Adel des Platins erhöht, um etwa 40 % verringert. Kern-Schale-Architekturen, die billigere Kernmaterialien (z. B. Pd) verwenden, verringern gleichzeitig den Edelmetallverbrauch und führen gleichzeitig eine Druckbelastung ein, um die Schalenstabilität zu erhöhen. Alternativ kann eine Dispersion auf atomarer Ebene durch einatomige Katalysatoren, die auf modifizierten Trägern verankert sind (z. B. Pt auf Zr-dotiertem CeO₂), eine außergewöhnliche Stabilität erreichen, die die strukturelle Integrität selbst unter rauen hydrothermalen Bedingungen bei 800 °C aufrechterhält, indem sie Partikelwanderung und Versinterung verhindert.
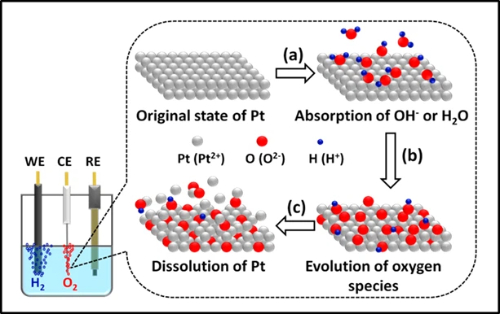
Abb. 5 Platinauflösungsphänomen im elektrochemischen Wasserspaltungsprozess zur Wasserstofferzeugung
2.5 Verlust der Selektivitätskontrolle
Die präzise Kontrolle der Reaktionswege stellt eine grundlegende Herausforderung bei komplexen mehrstufigen Reaktionen dar, bei denen Katalysatoren auf Palladiumbasis aufgrund nicht optimierter Adsorptionsenergien von Zwischenprodukten häufig eine eingeschränkte Selektivität aufweisen. Der zugrundeliegende Mechanismus, der die Selektivität steuert, liegt in der elektronischen Struktur der aktiven Stellen, insbesondere in der Position des d-Band-Zentrums, das die Adsorptionsstärke der Reaktanten und Zwischenprodukte bestimmt. Bei der elektrochemischen Reduktion von Nitrilen zu primären Aminen weisen herkömmliche Pd-Katalysatoren eine übermäßige Adsorptionsstärke gegenüber *CH₃CN-Zwischenprodukten auf, was unerwünschte tiefe Reduktionswege und Wasserstoffentwicklungsnebenreaktionen fördert, die zusammengenommen die Farada-Effizienz für die Zielprodukte verringern.
Fortgeschrittene Strategien für das Katalysatordesign gehen diese Einschränkungen erfolgreich an, indem sie die elektronischen und geometrischen Strukturen der Oberfläche präzise manipulieren. Die Technik der Gitterdehnung ist ein Beispiel für diesen Ansatz, bei dem Pd@Pd-Cu-Metallenaeros eine bemerkenswerte Ethylaminselektivität von 95,38 % erreichen, indem eine kontrollierte Druckdehnung eingeführt wird, die die Position des d-Band-Zentrums und die Stärke der Zwischenadsorption optimal abstimmt. Die Einbindung von Kupfer erzeugt präzise gespannte Palladiumoberflächen, die ein Gleichgewicht zwischen *CH₃CN-Aktivierung und *CH₃CH=NH-Zwischenstufenstabilisierung herstellen und konkurrierende Wege effektiv unterdrücken.
Weitere Innovationen ergeben sich aus hochentropischen Konstruktionsprinzipien, bei denen das hochentropische PdRhFeCoMo-Metallen die herkömmliche Symmetrie der Baustelle durch Konfigurationsstörungen stört. Dieser "Cocktaileffekt" schafft einzigartige lokale Koordinationsumgebungen, die die Ethanoladsorption und die Fähigkeit zur Spaltung von C-C-Bindungen erheblich verbessern, wodurch eine beispiellose Selektivität des C1-Weges von 84,12 % bei der Ethanoloxidation erreicht wird, während gleichzeitig die Vergiftungsresistenz durch ein verändertes Oberflächenwasserstoffverhalten verbessert wird.
Die bimetallische Synergie bietet zusätzliche Dimensionen für die Selektivitätsoptimierung, wie die Pt-Pd-Metallenaeros zeigen, bei denen der Einbau von Platin das d-Band-Zentrum des Palladiums moduliert, um zweifunktionale Katalysatoren zu schaffen, die gleichzeitig die anodische Ethanoloxidation und die kathodische Wasserstoffentwicklung fördern. Diese Optimierung der elektronischen Struktur gleicht die Adsorptionsenergien für verschiedene Zwischenprodukte über mehrere Reaktionen hinweg aus und ermöglicht so effiziente Kaskadenprozesse.
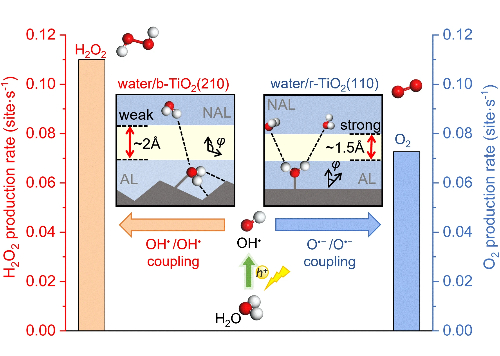
Abb. 6 Selektive Kontrolle der photokatalytischen Wasseroxidation
3 Drei materialspezifische Lösungen
3.1 Ansatz für Katalysatorlösungen auf Platinbasis
Katalysatoren auf Platinbasis (Pt) sind für die Sauerstoffreduktionsreaktion (ORR) an der Kathode von Protonenaustauschmembran-Brennstoffzellen (PEMFCs) unverzichtbar, doch ihre breite Kommerzialisierung wird nach wie vor durch drei grundlegende Probleme behindert: träge ORR-Kinetik, hohe Kosten aufgrund von Pt-Knappheit und strukturelle Degradation - einschließlich Auflösung, Migration und Versinterung von Pt-Nanopartikeln - unter dynamischen Betriebsbedingungen wie Potenzialwechsel und Hochspannung. Um diesen Einschränkungen zu begegnen, wurden fortschrittliche Materialdesignstrategien entwickelt, die sich hauptsächlich auf die folgenden drei Ansätze konzentrieren.

Abb. 7 Verbesserung der Stabilität von platinbasierten Katalysatoren für Brennstoffzellen
Lösung 1: Pt-M-Legierungen und Kern-Schale-Strukturen
Bei diesem Ansatz wird die elektronische Struktur von Pt durch die Einführung von Übergangsmetallen (M) maßgeschneidert, was sowohl die katalytische Aktivität als auch die Haltbarkeit erhöht und gleichzeitig die Pt-Beladung verringert.
Beschreibung der Strategie:
Nanopartikel aus Pt-Legierungen, die Übergangsmetalle wie Ni, Co, Fe oder Cu enthalten, werden durch nasschemische oder galvanische Austauschverfahren synthetisiert. Alternativ werden Kern-Schale-Architekturen (z. B. Pd@Pt) oder Pt-Haut-Strukturen konstruiert, bei denen eine Pt-reiche Schale ein preiswerteres Kernmaterial wie Pd oder ein unedles Metall umschließt.
Mechanismus der Wirkung:
Elektronischer (Liganden-)Effekt: Durch den Elektronentransfer von Übergangsmetallen auf Pt wird das d-Band-Zentrum von Pt nach unten verschoben, wodurch die Adsorptionsenergie von sauerstoffhaltigen Zwischenprodukten (z. B. O und OH) optimiert und dadurch die ORR-Kinetik beschleunigt wird. So weist die Pt3Ni(111)-Oberfläche eine mehr als zehnfach höhere ORR-Aktivität auf als Pt(111).
Geometrischer (Spannungs-)Effekt: Die Gitterfehlanpassung zwischen dem Kern und der Pt-Schale führt zu einer Druckverformung, die die elektronische Struktur von Pt weiter verfeinert und seine katalytische Leistung verbessert.
Wirtschaftlicher Nutzen:
Durch die Konzentration von Pt in der Oberflächenschicht maximieren Kern-Schale-Strukturen die Pt-Nutzungseffizienz und senken die Gesamtkosten des Katalysators erheblich.
Lösung 2: Morphologiekontrolle und Hochindex-Facettenbelichtung
Diese Strategie konzentriert sich auf die Formgebung von Pt-Nanokristallen, um hochaktive Kristallfacetten freizulegen und die Massenaktivität zu verbessern, ohne die chemische Zusammensetzung zu verändern.
Beschreibung der Strategie:
Mithilfe kolloidaler Synthesetechniken mit sorgfältig kontrollierten Tensiden und Reduktionskinetik werden wohldefinierte Pt-Nanostrukturen - wie Nanowürfel ({100}-Facetten), Oktaeder ({111}-Facetten) und dendritische Gerüste - hergestellt.
Mechanismus der Wirkung:
Hochaktive Facetten: Facetten mit hohem Index (z. B. {730}, {510}) weisen eine hohe Dichte an Stufen- und Knickatomen auf, die als stark ungesättigte aktive Stellen dienen. Diese Stellen erleichtern die Spaltung von O-O-Bindungen und die Desorption von Zwischenprodukten, was zu einer überragenden intrinsischen ORR-Aktivität führt.
Strukturelle Integrität: Bestimmte Architekturen - wie Nanorahmen und verzweigte Nanostrukturen - bieten robuste Gerüste, die der Partikelwanderung und Koaleszenz widerstehen und so die katalytische Stabilität verbessern.
Lösung 3: Stabile Träger und starke Metall-Träger-Interaktion
Dieser Ansatz zielt darauf ab, die Korrosion des Kohlenstoffträgers - eine der Hauptursachen für die Ablösung und den Abbau von Pt-Nanopartikeln - durch den Einsatz von robusten, funktionalisierten Trägermaterialien zu vermindern.
Beschreibung der Strategie:
Herkömmliche Kohlenstoffträger werden durch fortschrittliche Materialien ersetzt, darunter:
Graphitische Kohlenstoffe (z. B. Graphen, Kohlenstoff-Nanoröhren), die für ihre hohe elektrische Leitfähigkeit und Korrosionsbeständigkeit bekannt sind;
Heteroatom-dotierte Kohlenstoffe (z. B. N-, B-, P-dotiert), die die Wechselwirkung zwischen Metall und Träger verbessern und die elektronischen Eigenschaften verändern;
Metalloxide/-karbide (z. B. TiO2, SnO2, TiC), die eine ausgezeichnete Stabilität unter oxidierenden Bedingungen bieten.
Mechanismus der Wirkung:
Starke Metall-Träger-Wechselwirkung (SMSI): Funktionelle Gruppen oder Defekte auf der Trägeroberfläche bilden starke kovalente Bindungen (z. B. Pt-O-Ti) mit Pt-Nanopartikeln, wodurch Partikelwanderung, Ostwald-Reifung und Ablösung wirksam unterdrückt werden.
Verbesserte Langlebigkeit: Die überlegene elektrochemische Stabilität dieser Träger unter Hochpotentialbedingungen minimiert den korrosionsbedingten Pt-Verlust und verlängert so die Lebensdauer des Katalysators.
Tabelle 1 Vergleichstabelle für Katalysatorlösungen auf Platinbasis
|
Lösungen |
Kern-Strategien |
Mechanismen zur Steigerung der Aktivität |
Mechanismen zur Verbesserung der Stabilität |
Kosten-Wirksamkeit |
Schlüssel-Herausforderungen |
|
Pt-M-Legierungen und Kern-Schale-Strukturen |
Zusammensetzung und Strukturregulierung |
Ligandeneffekte und Dehnungseffekte optimieren gemeinsam die d-Band-Zentren von Pt, wodurch die ORR-Energiebarriere gesenkt wird. |
Legierungselemente oder Kernschichten verbessern das Auflösungspotenzial von Pt durch Stützeffekte; bestimmte Legierungselemente (z. B. Ni) bilden beim Auflösen Pt-Hautstrukturen, die die Oberflächenstabilität verbessern. |
Hoch (reduziert den Pt-Verbrauch erheblich) |
Übergangsmetalle können in sauren Umgebungen ausgelaugt werden, was zu Aktivitätsabfall und Membranverschmutzung führt; die Verfahren zur Herstellung von Kern-Schale-Strukturen sind komplex. |
|
Morphologiekontrolle und Hochindex-Kristallebenen |
Oberflächentechnik |
Die Freilegung von Hochindex-Kristallebenen mit hochdichten ungesättigten Koordinationsatomen bietet hochgradig intrinsische aktive Stellen. |
Vernetzte Strukturen mit spezifischen Morphologien (z. B. Dendriten, Nanorahmen) unterdrücken die Partikelwanderung. |
Mäßig (hohe Pt-Nutzung, aber relativ hohe Synthesekosten) |
Kristallebenen mit hohem Index sind unter Reaktionsbedingungen in der Regel instabil und lassen sich leicht in Ebenen mit niedriger Energie umwandeln; Herausforderungen bestehen in der Erreichung einer skalierbaren Synthese und Reproduzierbarkeit. |
|
Stabile Träger mit starken Metall-Träger-Wechselwirkungen |
Trägertechnik |
Dotierte Kohlenstoffträger können die elektronische Struktur von Pt durch elektronische Effekte modulieren; Verbesserung des Stofftransfers. |
Starke Wechselwirkungen verankern Pt-Partikel; hochstabile Träger widerstehen Korrosion und verhindern die Ablösung von Partikeln. |
Mäßig (Trägerkosten können steigen, verlängern aber die Lebensdauer) |
Einige hochstabile Träger (z. B. Metalloxide) weisen eine schlechte Leitfähigkeit auf, was den Grenzflächenwiderstand erhöhen kann; eine genaue Kontrolle der Mechanismen der Metall-Träger-Interaktion ist erforderlich. |
3.2 Katalysatorlösungen auf Palladiumbasis
Katalysatoren auf der Basis von Palladium (Pd) sind in der chemischen Feinsynthese von zentraler Bedeutung, insbesondere bei Kreuzkupplungs- und selektiven Hydrierungs-/Oxidationsreaktionen. Ihre praktische Umsetzung wird jedoch durch drei große Herausforderungen behindert: die Schwierigkeit, homogene Pd-Katalysatoren trotz ihrer hohen Selektivität wiederzugewinnen und wiederzuverwenden; die ungleichmäßigen aktiven Stellen in heterogenen Pd-Katalysatoren, die zu Problemen wie Auslaugung und sinterungsbedingter Deaktivierung führen; und die erhebliche Schwierigkeit, die chemische, Regio- und Stereoselektivität präzise zu kontrollieren. Um Aktivität, Stabilität und Selektivität gleichzeitig zu erreichen, wurden die folgenden fortschrittlichen Strategien entwickelt.
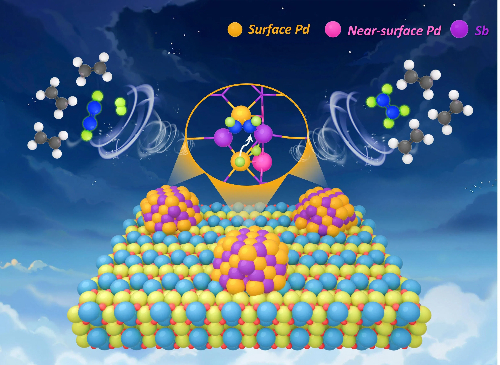
Abb. 8 Hydrierungsstelle eines Katalysators auf Palladiumbasis für Alkene
Lösung 1: Ein-Atom-Katalysatoren
Bei diesem Ansatz wird Pd als isolierte Atome stabilisiert, um strukturell einheitliche aktive Stellen zu schaffen, die einen idealen Weg zu maximaler Selektivität und atomarer Effizienz bieten.
Beschreibung der Strategie:
Einzelne Pd-Atome werden auf defektreichen Trägern - wie Metalloxiden (CeO2, TiO2), Kohlenstoffnitrid (g-C3N4) oder stickstoffdotiertem Kohlenstoff (N-C) - verankert, u. a. durch starke elektrostatische Adsorption, Kopräzipitation oder Hochtemperaturpyrolyse.
Mechanismus der Wirkung:
Maximierte Atomeffizienz und einheitliche aktive Stellen: Jedes Pd-Atom dient als unabhängiger und strukturell identischer aktiver Ort, wodurch eine nahezu theoretische atomare Ausnutzung erreicht wird. Diese Einheitlichkeit verhindert Nebenreaktionen, die durch heterogene aktive Stellen verursacht werden, und ermöglicht eine außergewöhnlich hohe Selektivität der Zielprodukte.
Erhöhte Stabilität: Starke kovalente Wechselwirkungen zwischen Pd-Atomen und Heteroatomen (z. B. O, N) auf der Trägeroberfläche immobilisieren die Pd-Spezies effektiv und unterdrücken Migration, Agglomeration und Auslaugung, wodurch die katalytische Haltbarkeit über mehrere Zyklen verbessert wird.
Lösung 2: Nanocluster und Begrenzungskatalyse
Diese Strategie konzentriert sich auf die präzise Kontrolle der Anzahl der Pd-Atome und die Ausnutzung der räumlichen Begrenzung, um das katalytische Verhalten im Sub-Nanometerbereich zu optimieren und Selektivität auf molekularer Ebene zu ermöglichen.
Beschreibung der Strategie:
Pd-Cluster mit genau definiertem Kern (z. B. Pd4, Pd8) werden mit präzisen kolloidalen oder chemischen Methoden synthetisiert. Alternativ dazu werden Pd-Spezies in die geordneten porösen Gerüste von Zeolithen oder metallorganischen Gerüsten (MOFs) mittels Flaschenschiffsynthese eingekapselt.
Mechanismus der Wirkung:
Quantengrößen-Effekte: Im Subnanometerbereich weist Pd diskrete elektronische Strukturen auf, die sich sowohl von einzelnen Atomen als auch von größeren Nanopartikeln unterscheiden, was zu einzigartigen katalytischen Eigenschaften und zur Aktivierung spezifischer Reaktionswege führt.
Räumliche Begrenzung und formselektive Katalyse: Die begrenzten Porenumgebungen von Zeolithen oder MOFs wirken als Nanoreaktoren, die:
Selektive Aufnahme von Reaktanten und Freisetzung von Produkten auf der Grundlage von Molekülgröße und -form (Größenselektivität),
die Geometrien der Übergangszustände einschränken, um die Stereochemie der Reaktion zu kontrollieren (Stereoselektivität),
Physikalische Isolierung von Pd-Clustern, um Aggregation und Wachstum zu verhindern.
Lösung 3: In-situ-Bildung von Pd-Nanopartikeln in flüssiger Phase
Dieser Ansatz nutzt ein dynamisches katalytisches System, bei dem aktive Pd-Spezies in situ erzeugt werden, und kombiniert die hohe Leistung der homogenen Katalyse mit der einfachen Rückgewinnung der heterogenen Katalyse.
Beschreibung der Strategie:
Lösliche Pd-Vorläufer (z. B. Pd(OAc)2) oder ligandenstabilisierte Komplexe werden in das Reaktionsgemisch eingebracht, wo sie unter Reaktionsbedingungen in situ reduziert werden, um hochaktive Pd-Nanopartikel oder -Nanocluster auf dem Träger oder im flüssigen Medium zu bilden.
Mechanismus der Wirkung:
Synergie zwischen homogener und heterogener Katalyse: Die in situ gebildeten Pd-Nanopartikel sind klein, defekt und hochaktiv und ähneln in ihrer Leistung homogenen Katalysatoren. Nach der Reaktion können diese Spezies in weniger aktive oder unlösliche Formen umgewandelt werden (z. B. durch Oxidation oder Agglomeration), was eine unkomplizierte Trennung und Wiederverwertung ähnlich wie bei heterogenen Systemen ermöglicht.
Abschwächung der Deaktivierung: Dieser dynamische Prozess löst den Kompromiss zwischen Stabilität und Aktivität auf: Während der Reaktion bilden sich hochaktive kleine Partikel, während nach der Reaktion ein stabilerer Zustand angenommen wird, wodurch irreversibles Sintern und Deaktivierung während der Wiederverwendung minimiert werden.
Tabelle 2 Horizontale Vergleichstabelle für Katalysatorlösungen auf Palladiumbasis
|
Lösung |
Kern Strategie |
Selektivität Stärke |
Stabilität Mechanismus |
Atomverwendung |
Anwendbare Szenarien |
|
Einzel-Atom-Katalysatoren |
Atomare Dispersion und strukturelle Homogenisierung |
Chemische und Stereoselektivität |
Starke Metall-Träger-Bindung |
~100% |
Selektive Hydrierung, CO-Oxidation |
|
Nanocluster und begrenzte Katalyse |
Präzise Kernbildung und räumlicher Einschluss |
Größe und Stereoselektivität |
Physikalischer Einschluss verhindert Agglomeration |
Hohe |
Chirale Synthese, formselektive Reaktionen |
|
In-situ-Bildung von Pd-Nanopartikeln |
Dynamische Bildung aktiver Spezies |
Chemische Selektivität |
Dynamisches Gleichgewicht verringert die Versinterung |
Hoch während der Reaktion, erfordert Reaktivierung |
Recycelbare feinchemische Synthese |
3.3 Katalysatorlösungen auf Goldbasis
Gold (Au) ist zwar in seiner massiven Form chemisch inert, zeigt aber eine außergewöhnliche katalytische Aktivität, wenn es im Nanomaßstab hergestellt und richtig unterstützt wird - eine bahnbrechende Entdeckung, die die moderne Katalyse neu gestaltet hat. Der praktische Einsatz von Katalysatoren auf Goldbasis steht jedoch vor drei großen Herausforderungen: die inhärente Inertheit von Au-Masse, die starke Tendenz von Au-Nanopartikeln, unter Reaktionsbedingungen zu versintern oder der Ostwald-Reifung zu unterliegen, was zu einer schnellen Deaktivierung führt, und die Empfindlichkeit gegenüber Feuchtigkeit und bestimmten Vergiftungsarten. Um diese Einschränkungen zu überwinden und das volle Potenzial von Au-Nanokatalysatoren zu erschließen, wurden mehrere fortschrittliche Designstrategien entwickelt, die im Folgenden beschrieben werden.
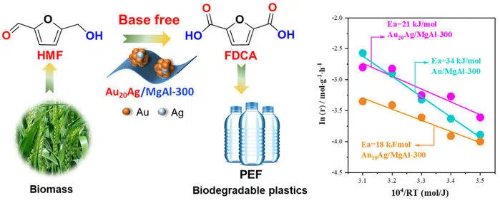
Abb. 9 Goldbasierte Katalysatoren für die Biokonversion
Lösung 1: Größenkontrolle und Support Engineering
Bei diesem Ansatz werden Quanteneffekte und Trägerwechselwirkungen genutzt, um Au-Nanopartikel durch genaue Kontrolle ihrer Größe und ihres Dispersionszustands zu aktivieren.
Beschreibung der Strategie:
Gold-Nanopartikel, die kleiner als 5 nm sind - optimal im Bereich von 2 bis 3 nm - werden durch Methoden wie Abscheidung-Fällung oder kolloidale Synthese synthetisiert und auf reduzierbare Metalloxidträger wie TiO2, Fe2O3 und CeO2 aufgebracht.
Mechanismus der Wirkung:
Effekte der Quantengröße: Wenn die Größe der Au-Partikel unter ∼5 nm sinkt, geht ihre elektronische Struktur von metallisch zu nichtmetallisch über, was zu einem hohen Anteil an unterkoordinierten Oberflächenatomen (z. B. Stufen, Kanten) führt. Diese Stellen weisen eine verstärkte Adsorptions- und Aktivierungsfähigkeit für kleine Moleküle wie CO und O2 auf und bilden den grundlegenden Ursprung der katalytischen Aktivität von Au.
Träger-vermittelte Aktivierung: Bestimmte Metalloxidträger stabilisieren nicht nur Au-Nanopartikel, sondern sind auch direkt an katalytischen Zyklen beteiligt. Bei der CO-Oxidation über den Mars-van-Krevelen-Mechanismus reagiert beispielsweise der Gittersauerstoff des Trägers (z. B. CeO2) mit CO, während O2 aus der Gasphase die Sauerstofflücken auffüllt, wodurch ein synergistischer katalytischer Kreislauf zwischen Au und dem Träger entsteht.
Lösung 2: Au-Träger-Grenzfläche und bifunktionale Stellen
Diese Strategie konzentriert sich auf die gezielte Gestaltung von Grenzflächen zwischen Au-Nanopartikeln und dem Träger, an denen die synergistische Katalyse stattfindet.
Beschreibung der Strategie:
Durch sorgfältige Kontrolle der Syntheseparameter - wie Auswahl der Trägerfacetten, Kalzinierungstemperatur und Atmosphäre - werden die Au-Nanopartikel fein verteilt, um die Dichte und Stabilität der Au-Träger-Grenzflächen zu maximieren.
Mechanismus der Wirkung:
Bifunktionale Katalyse an der Grenzfläche: Bei Schlüsselreaktionen wie der CO-Oxidation bei niedrigen Temperaturen befindet sich die aktive Stelle häufig am Rande des Au-Trägers. Hier erleichtert Au die Adsorption und Aktivierung von CO, während der benachbarte Träger O2 (oder H2O) aktiviert. Diese räumliche und funktionelle Arbeitsteilung senkt die Aktivierungsbarriere erheblich und erhöht die Reaktionsgeschwindigkeit durch synergistische Wechselwirkungen.
Lösung 3: Legierung und Oberflächenmodifikation
Dieser Ansatz verbessert sowohl die Aktivität als auch die Stabilität von Au-Katalysatoren durch die Einführung eines zweiten Metalls oder Oxidmodifikators zur Anpassung der elektronischen und strukturellen Eigenschaften.
Beschreibung der Strategie:
Au wird mit anderen Metallen (z. B. Pd, Pt, Ag) legiert oder mit Metalloxiden (z. B. FeOx, TiOx) oberflächenmodifiziert, um legierte Nanopartikel oder Kern-Schale- und dekorierte Architekturen zu bilden.
Mechanismus der Wirkung:
Elektronische Modulation: Durch die Einführung eines zweiten Elements wird die Elektronendichte der Au-Atome über Ligandeneffekte verändert, wodurch die Adsorptionsstärke der Zwischenprodukte fein abgestimmt und die Reaktionsmöglichkeiten über das hinaus erweitert werden, was reines Au erreichen kann.
Strukturelle Stabilisierung: Die sekundäre Komponente fungiert als physikalischer Abstandshalter, der den direkten Kontakt und das Zusammenwachsen der Au-Partikel während der thermischen Behandlung oder der Reaktion verhindert und so die Sinterungsbeständigkeit und die Betriebslebensdauer verbessert.
Tabelle 3 Horizontale Vergleichstabelle für Katalysatorlösungen auf Goldbasis
|
Lösungen |
Kernstrategie |
Aktive Stelle |
Mechanismus zur Verbesserung der Stabilität |
Vorteile |
Zentrale Herausforderungen |
|
Größeneffekt und Auswahl des Trägers |
Kontrolle der Partikelgröße (<5 nm) durch spezifische Träger |
Atome mit geringer Koordination auf der Oberfläche kleiner Au-Partikel; Aktivierungsstellen, an denen Träger beteiligt sind |
Ladungsträger bieten Verankerungsstellen und unterdrücken die Partikelwanderung |
Hohe intrinsische Aktivität, verschiedene Trägeroptionen und eingehende Untersuchungen des Mechanismus |
Thermodynamische Instabilität der kleinen Partikel, Neigung zum Sintern; starke Abhängigkeit von den Eigenschaften der Träger |
|
Konstruktion der Au-Träger-Grenzfläche |
Präzise Kontrolle der Kontaktschnittstelle zwischen Au und dem Träger |
Doppelfunktionale Stellen an der Au-Träger-Grenzfläche |
Starke Metall-Träger-Wechselwirkungen stabilisieren Au-Partikel |
Vollständige Ausnutzung der Synergieeffekte zwischen Gold und dem Träger mit gut definierten aktiven Stellen |
Die Grenzflächenstruktur kann sich während der Reaktionen umgestalten, was eine hohe Reproduzierbarkeit bei der Herstellung voraussetzt |
|
Legierung und Oberflächenmodifikation |
Einführung einer zweiten Komponente zur Regulierung der elektronischen und geometrischen Strukturen |
Au-Atome in der Nähe von Legierungsoberflächen oder modifizierten Schichten |
Die zweite Komponente wirkt als physikalische Barriere und verhindert, dass Au-Partikel mit gesinterten Schichten in Kontakt kommen |
Verbessert gleichzeitig die Aktivität und die thermische Stabilität mit starker Abstimmbarkeit |
Kann Kosten oder Komplexität verursachen; die zweite Komponente kann sich absetzen oder auslaugen |
4 Umfassender Vergleich und Ausblick
4.1 Umfassender Vergleich
Durch eine eingehende Analyse der drei wichtigsten Edelmetallkatalysatoren - Platin (Pt), Palladium (Pd) und Gold (Au) - können wir ihre Eigenschaften und Lösungen systematisch zusammenfassen und gemeinsame Konstruktionsprinzipien und zukünftige Entwicklungsrichtungen herausarbeiten.
Tabelle 4 Umfassender Vergleich von drei Edelmetallkatalysatoren
|
Werkstoff |
Hauptanwendung |
Hauptproblem |
Zentrale Lösung |
Wirkung und Eigenschaften |
|
Pt |
Elektrokatalyse |
Kosten, Aktivität, Stabilität |
Legierung/Kern-Schale/Morphologiekontrolle |
Verbesserung der intrinsischen Aktivität, Reduzierung der Dosierung |
|
Pd |
Chemische Synthese |
Selektivität, Rückgewinnung, Deaktivierung |
Einzelatom/Cluster/Einzelne |
Ermöglicht präzise Synthese und einfache Trennung |
|
Au |
Umweltkatalyse |
Inhärent inert, anfällig für Versinterung |
Dimensionskontrolle/Grenzflächentechnik |
Aktiviert die Leistung, verbessert die thermische Stabilität |
4.2 Extraktion von universellen Designprinzipien
Obwohl die drei Katalysatoren vor unterschiedlichen Herausforderungen stehen, lassen sich aus ihren Lösungen gemeinsame Prinzipien für das Design katalytischer Materialien ableiten:
Die Grenzflächentechnik ist überall von entscheidender Bedeutung: Ob an Pt-Träger-, Au-Träger- oder Pd-Träger-Grenzflächen, diese Bereiche sind entscheidend für den Aufbau einer synergistischen Katalyse, die Verbesserung der Metall-Träger-Wechselwirkungen und die Verbesserung der Stabilität. Die Grenzflächen dienen als primäres Schlachtfeld für die Überwindung der Grenzen der einzelnen Materialien.
Die Modulation der elektronischen Struktur ist für die Verbesserung der Eigenaktivität von zentraler Bedeutung: Die Modulation der d-Band-Zentren aktiver Stellen durch Legierung, Dotierung, Dehnungsänderung und andere Mittel zur Optimierung der Adsorptions-/Desorptions-Energiebarrieren für Reaktionszwischenprodukte ist eine universelle Strategie zur Überwindung von Engpässen bei der katalytischen Aktivität.
Die Kontrolle der geometrischen Struktur ist ein leistungsfähiges Instrument zur Stabilisierung von Katalysatoren und zur Regulierung der Selektivität: Eine präzise Kontrolle der geometrischen Anordnung aktiver Stellen - von einzelnen Atomen und Nanoclustern bis hin zu Kristallebenen mit hohem Brechungsindex - kann gleichzeitig die Aktivität erhöhen, indem die Zahl der niedrig koordinierten Atome erhöht wird, während die Reaktionswege und die Selektivität durch sterische Hindernisse und Confinement-Effekte präzise gesteuert werden.
4.3 Ausblick auf die Zukunft
Mit Blick auf die Zukunft tritt die Forschung im Bereich der Edelmetallkatalysatoren in eine neue Phase ein, die durch eine tiefgreifende multidisziplinäre Integration, datengesteuerte Ansätze und eine starke Betonung der nachhaltigen Entwicklung gekennzeichnet ist.
Die Integration verschiedener Materialsysteme und die gegenseitige Befruchtung von Designphilosophien werden sich als Schlüsselrichtungen herausstellen. Beispielsweise könnte die Anwendung des ausgereiften Kern-Schale-Strukturkonzepts von platinbasierten Katalysatoren auf Palladiumsysteme den Katalysatorverbrauch und die Kosten weiter senken. Oder die Anwendung ausgeklügelter Strategien der Grenzflächentechnik von Katalysatoren auf Goldbasis zur Verbesserung der Haltbarkeit von Elektrokatalysatoren auf Platinbasis könnte durch diese gegenseitige Befruchtung von Ideen zu neuartigen Hochleistungskatalysatorsystemen führen.
Die synergetische Entwicklung von künstlicher Intelligenz und fortschrittlichen Charakterisierungstechniken wird die F&E-Paradigmen tiefgreifend verändern: Einerseits wird das maschinelle Lernen ein virtuelles Screening mit hohem Durchsatz ermöglichen, bei dem aus einer Vielzahl von Kombinationen von Zusammensetzung, Struktur und Trägern schnell optimale Lösungen ermittelt werden, um Katalysatoren "auf Abruf" anzupassen. Andererseits werden bahnbrechende in-situ/operative Charakterisierungstechniken wie Synchrotronstrahlung und Umgebungs-Rasterelektronenmikroskopie die Echtzeit-Beobachtung der dynamischen strukturellen Entwicklung in der tatsächlichen Reaktionsumgebung auf atomarer Ebene ermöglichen. Dieser einheitliche Ansatz wird die Natur aktiver Stellen und Deaktivierungsmechanismen offenlegen und zu einem gezielteren rationalen Design führen.
Letztlich müssen all diese technologischen Fortschritte dem großen Ziel der nachhaltigen Entwicklung dienen. Das bedeutet, dass umweltfreundliche Recycling-Technologien für Edelmetalle und die Schaffung von Kreislaufwirtschaftssystemen ebenso wichtig werden wie das Leistungsdesign von Katalysatoren selbst. Gleichzeitig wird die Entwicklung alternativer Katalysatoren mit extrem niedrigen Edelmetallgehalten oder sogar völlig edelmetallfreien Alternativen der grundlegende Weg sein, um die Ressourcenknappheit anzugehen und eine langfristige Entwicklung im Chemie- und Energiesektor zu erreichen.

Abb. 10 Anwendungen von Edelmetallkatalysatoren
Partner für fortschrittliche katalytische Lösungen
Stanford Advanced Materials (SAM) liefert hochreine Pt-, Pd- und Au-Katalysatoren und -Träger, die auf Ihre F&E- und industriellen Bedürfnisse zugeschnitten sind. Kontaktieren Sie unser technisches Team, um kundenspezifische Lösungen zu besprechen.
Referenz
[1] Zandkarimi, B.; Poths, P.; Alexandrova, A. N. When Fluxionality Beats Size Selection: Beschleunigung der Ostwald-Reifung von Sub-Nano-Clustern. Angew. Chem. Int. Ed. 2021, *60* (11), 5701-5704. DOI: 10.1002/anie.202100107.
[2] Zhang, S.; Han, Y.; Zhu, B.; Gao, Y. Particle Hopping and Coalescence of Supported Au Nanoparticles in Harsh Reactive Environments. J. Am. Chem. Soc. 2025. DOI: 10.1021/jacs.5c03633.
[3] Liu, L.; Lu, J.; Wang, L.; Xiao, F.-S. Dealuminierter Beta-Zeolith kehrt die Ostwald-Reifung für langlebige Kupfer-Nanopartikel-Katalysatoren um. Wissenschaft 2023, *382* (6673), 771-776. DOI: 10.1126/science.adj1962.
[4] Li, W.; Ouyang, R. Stability of Nanocatalysts under Reaction Conditions: A Theoretical Study. J. Am. Chem. Soc. 2013, *135* (5), 1760-1771. DOI: 10.1021/ja3087054.
[5] Li, W., & Ouyang, R. (2013). Stability of Nanocatalysts under Reaction Conditions: A Theoretical Study. Journal of the American Chemical Society, 135(5), 1760-1771. DOI: 10.1021/ja3087054.
[6] Yin, P., Hu, S., Liang, H., & Li, W. (2021). Quantifizierung des kritischen Partikelabstands zur Abschwächung der Katalysatorversinterung. Nature Communications, 12, 4865. DOI: 10.1038/s41467-021-25116-2.

 Bars
Bars
 Perlen & Kugeln
Perlen & Kugeln
 Bolzen & Muttern
Bolzen & Muttern
 Tiegel
Tiegel
 Scheiben
Scheiben
 Fasern & Stoffe
Fasern & Stoffe
 Filme
Filme
 Flocke
Flocke
 Schaumstoffe
Schaumstoffe
 Folie
Folie
 Granulat
Granulat
 Honigwaben
Honigwaben
 Tinte
Tinte
 Laminat
Laminat
 Klumpen
Klumpen
 Maschen
Maschen
 Metallisierte Folie
Metallisierte Folie
 Platte
Platte
 Pulver
Pulver
 Stab
Stab
 Blätter
Blätter
 Einkristalle
Einkristalle
 Sputtering Target
Sputtering Target
 Rohre
Rohre
 Waschmaschine
Waschmaschine
 Drähte
Drähte
 Umrechner & Rechner
Umrechner & Rechner
 Schreiben Sie für uns
Schreiben Sie für uns



 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


