Lithium: Elementeigenschaften und Verwendungen
Das Element Lithium verstehen
Was ist Lithium?
Lithium, Ordnungszahl 3 und Symbol Li, ist das leichteste Metall im Periodensystem und ein Alkalimetall. In den zwei Jahrhunderten seines Bestehens als Laborkuriosität hat sich Lithium zu einem weltweit gehandelten Industrierohstoff entwickelt. Heute bildet die Lithiumraffination und -produktion - durch Elektrolyse von Salz oder Mahlen von Mineralien wie Spodumen - die Grundlage für eine milliardenschwere Industrie in den Bereichen Energiespeicherung, Weltraumforschung und Elektronik.

Chemische Eigenschaften Beschreibung
Die chemischen Eigenschaften vonLithium spiegeln seine physikalischen Eigenschaften wider, die ebenso ausgeprägt sind:
-Reaktivität: Lithium reagiert heftig mit Wasser unter Bildung von Lithiumhydroxid (LiOH) und Wasserstoffgas. So kann beispielsweise ein kleines Stück Lithium, das in Wasser getaucht wird, innerhalb von Sekunden ein sichtbares Sprudeln entwickeln.
-Alkalische Natur: Als weiteres Alkalimetall gibt Lithium sein eines Außenelektron leicht ab, um das Li⁺-Ion zu bilden, und wird so zu einem wichtigen Akteur in elektrochemischen Reaktionen, auch in Lithium-Ionen-Batterien.
- Entflammbarkeit: Lithium entzündet sich mit einer charakteristischen roten Flamme, was die Ingenieure bei der Arbeit mit und der Lagerung von Massenlithium beachten müssen.
Datentabelle der physikalischen Eigenschaften
|
Eigenschaft |
Wert |
|
Ordnungszahl |
3 |
|
Atommasse |
6,94 g/mol |
|
Schmelzpunkt |
180.54 °C |
|
Siedepunkt |
1590 °C |
|
Dichte |
0,534 g/cm³ |
|
Erscheinungsbild |
Silbrig-weißes Metall |
|
Härte |
Weich |
|
Elektrische Leitfähigkeit |
Hoch |
|
Thermische Leitfähigkeit |
Hohe |
Entdeckung von Lithium
Lithium wurde erstmals 1817 in Petalit auf der Insel Utö in Schweden entdeckt. Die Analyse von Arfvedson ergab ein neues, nicht identifiziertes Element mit anderen Eigenschaften als Natrium oder Kalium. Später wurde metallisches Lithium durch Elektrolyse von Lithiumsalzen abgetrennt, damit Wissenschaftler und Ingenieure seine physikalischen und chemischen Eigenschaften weiter analysieren konnten. Die merkwürdige Kombination aus Leichtigkeit, hoher Reaktivität und elektrochemischem Potenzial von Lithium führte dazu, dass es im Laufe der Zeit von der Energiespeicherung über Industriefette bis hin zur Medizin eingesetzt wurde.
Legierungen und Lithium-Verbindungen
- Lithium-Aluminium-Legierungen: Extrem leicht und hart, wird in Flugzeug- und Sportwagenbauteilen verwendet.
- Lithium-Kupfer-Legierungen: Verbessern die elektrische Leitfähigkeit und werden häufig in elektronischen Steckern und Schaltkreisen verwendet.
- Lithium-Eisen-Phosphat (LiFePO₄): Wird wegen seiner Stabilität und langen Lebensdauer häufig in Kathoden von Elektroautobatterien verwendet.
- Lithiumhydroxid (LiOH) und -carbonat (Li₂CO₃): Von zentraler Bedeutung für Akkus, Schmierfette und industrielle chemische Prozesse.
- Lithiumchlorid (LiCl): Wird in Trockenmitteln, Klimaanlagen und in der chemischen Synthese verwendet.
Tesla und andere Hersteller von Elektrofahrzeugen setzen beispielsweise Lithium-Eisen-Phosphat-Batterien (LFP) in bestimmten Fahrzeugflotten ein, bei denen thermische Stabilität und Energiedichte von größter Bedeutung sind, um Sicherheit und Funktionalität zu gewährleisten.
Allgemeine Anwendungen
Es gibt verschiedene Anwendungen für Lithium:
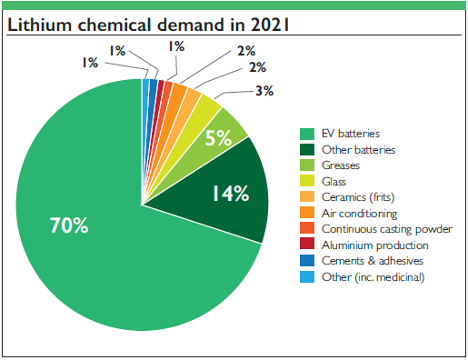
1. Batterien: Lithium-Ionen- und Lithium-Polymer-Batterien dominieren aufgrund ihrer hohen Energiedichte den Markt für tragbare Elektronikgeräte, Elektrofahrzeuge und Systeme zur Speicherung erneuerbarer Energien.
2. Legierungen: Lithium macht Aluminium- und Kupferlegierungen leichter und verbessert so die Effizienz in der Luft- und Raumfahrt, ohne die Festigkeit zu beeinträchtigen.
3. Medizinische Anwendungen: Lithiumcarbonat stabilisiert Patienten mit bipolarer Störung, was zeigt, dass Lithium nicht nur in der Industrie verwendet werden kann.
4. Hitzebeständiges Glas und Keramik: Lithium erhöht die Temperaturwechselbeständigkeit und Festigkeit.
5. Schmierfette: Lithium-Schmierfette haben eine gute Leistung bei hohen Temperaturen und Drücken, was in der Fertigungs- und Automobilindustrie wichtig ist.
 [1]
[1]
Herstellungsverfahren
Lithium wird hauptsächlich gewonnen durch:
1. Lithiummetall wird durch Elektrolyse aus LiCl oder LiF gewonnen, um eine hohe Reinheit für Marktanwendungen zu erzielen.
2. Gewinnung von Mineralien: Spodumen und Petalit werden zu Lithiumcarbonat oder -hydroxid verarbeitet, das für die Herstellung von Batterien und Chemikalien verwendet wird.
Häufig gestellte Fragen
Was sind die häufigsten Anwendungen für Lithium?
Vor allem in wiederaufladbaren Batterien, Leichtmetalllegierungen, Schmierfetten und Arzneimitteln.
Wie wird Lithium abgebaut?
Durch Elektrolyse von Lithiumsalzen oder aus Spodumenerzen.
Ist Lithium reaktionsfähig?
Ja, vor allem mit Wasser, wobei LiOH und Wasserstoffgas entstehen.
Was sind Lithium-Ionen-Batterien?
Aufgrund ihrer hohen Energiedichte und langen Lebensdauer liefern sie Strom für Smartphones, Laptops, Elektrofahrzeuge und Speichersysteme für erneuerbare Energien.
Referenz:
[1] Internationale Lithium-Vereinigung (2023, 13. Oktober). Lithium 101. Abgerufen am 17. Juli 2025, von https://lithium.org/lithium-101/

 Bars
Bars
 Perlen & Kugeln
Perlen & Kugeln
 Bolzen & Muttern
Bolzen & Muttern
 Tiegel
Tiegel
 Scheiben
Scheiben
 Fasern & Stoffe
Fasern & Stoffe
 Filme
Filme
 Flocke
Flocke
 Schaumstoffe
Schaumstoffe
 Folie
Folie
 Granulat
Granulat
 Honigwaben
Honigwaben
 Tinte
Tinte
 Laminat
Laminat
 Klumpen
Klumpen
 Maschen
Maschen
 Metallisierte Folie
Metallisierte Folie
 Platte
Platte
 Pulver
Pulver
 Stab
Stab
 Blätter
Blätter
 Einkristalle
Einkristalle
 Sputtering Target
Sputtering Target
 Rohre
Rohre
 Waschmaschine
Waschmaschine
 Drähte
Drähte
 Umrechner & Rechner
Umrechner & Rechner
 Schreiben Sie für uns
Schreiben Sie für uns




 Chin Trento
Chin Trento



